

分析 根据A、B、C、D是初中化学常见的物质,D是大理石的主要成分,所以D是CaCO3,B、C为氧化物,由转化关系可知C为CO2,B为有毒气体,所以B是CO,A为无色气体单质,会转化成一氧化碳和二氧化碳,所以A是O2,以此解答该题.
解答 解:A、B、C、D是初中化学常见的物质,D是大理石的主要成分,所以D是CaCO3,B、C为氧化物,由转化关系可知C为CO2,B为有毒气体,所以B是CO,A为无色气体单质,会转化成一氧化碳和二氧化碳,所以A是O2,
(1)由以上分析可知A是O2,D是CaCO3,故答案为:O2;CaCO3;
(2)物质C转化为物质B的反应是二氧化碳和碳高温生成一氧化碳,化学方程式为:CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO,为吸热反应,故答案为:CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO;吸热;
(3)C可与CuO反应生成CO2,反应的方程式为C+2CuO$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+CO2,故答案为:C+2CuO$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+CO2.
点评 本题考查无机物的推断,为高频考点,侧重于学生的分析能力的考查,涉及元素化合物知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.005mol | B. | 0.01mol | C. | 0.025mol | D. | 0.03mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
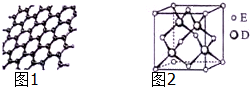 原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期.A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族相邻;E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:
原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期.A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族相邻;E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -3 | B. | +4 | C. | +3 | D. | +2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Cl-、Cu2+、Ba2+ | B. | OH-、NO${\;}_{3}^{-}$、Ba2+、Cl- | ||
| C. | H+、CO${\;}_{3}^{2-}$、Mg2+、Ba2+ | D. | OH-、NO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol OH-含有的电子数为9NA | |
| B. | 常温常压下,NO2和N2O4的混合物23g中含有NA个氧原子 | |
| C. | 标准状况下,2.8gN2和2.24L CO所含电子数均为1.4NA | |
| D. | 标准状况下,22.4 L 乙醇中含有NA个乙醇分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入盐酸 | B. | 加入Ba(OH)2溶液 | C. | 测定溶液的pH值 | D. | 加入品红溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com