
| A. | 436 kJ | B. | 557 kJ | C. | 920 kJ | D. | 618 kJ |
科目:高中化学 来源: 题型:解答题
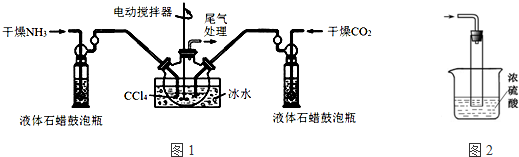
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
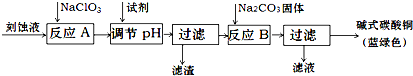
| 物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO的燃烧热为566.0 kJ•mol-1 | |
| B. | 反应②△H<0,所以该反应能自发进行 | |
| C. | 使用催化剂能提高其转化率 | |
| D. | 根据①和②推知总反应为2CO(g)+SO2(g)=S(s)+2CO2 (g)△H=-270kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清的石灰水与稀硝酸反应:OH-+H+═H2O | |
| B. | 氢氧化钡溶液与硫酸的反应:OH${\;}^{{-}^{\;}}$+H+═H2O | |
| C. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 醋酸溶液与碳酸钙反应:CaCO3+2H+═Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能自发进行 | B. | 不能自发进行 | ||
| C. | 可能自发进行 | D. | 在加热条件下才能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸的电离:H2CO3═2H++HCO3- | |
| B. | 将金属钠加入水中:2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 硫化钠水解:S2-+2H2O?H2S↑+2OH- | |
| D. | 向氯化铝溶液中加入过量的烧碱溶液:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com