
【题目】分枝酸的结构简式如图,下列关于分枝酸的叙述正确的是

A. 分枝酸的分子式为C10H8O6
B. 分枝酸分子中含有2种含氧官能团
C. 可与乙醇、乙酸反应,也可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色
D. 1mol该有机物与NaOH溶液反应,最多消耗3mol NaOH
 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和所得结论错误的是 ( )
选项 | 操作 | 现象 | 结论 |
A | 向蔗糖中加入浓硫酸 | 蔗糖变成疏松多孔的海绵状炭,并放出有刺激性气味的气体 | 浓硫酸具有脱水性和强氧化性 |
B | 向久置的Na2SO3溶液中加入足量Ba(NO3)2溶液,再加入足量稀盐酸 | 先出现白色沉淀,然后部分沉淀溶解 | 部分Na2SO3被氧化 |
C | 某溶液中滴加K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | 原溶液中有Fe2+,可能有Fe3+ |
D | 向等浓度的KCl、KI混合液中逐滴滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的叙述正确的是 ( )
A. C4H10有3种同分异构体
B. 葡萄糖、果糖的分子式均为C6H12O6,两者互为同分异构体
C. 戊烷(C5H12)有4种同分异构体
D. 主链含5个碳原子,有3个甲基支链的烷烃有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用。下列说法正确的是( )

A.O2在石墨Ⅱ附近发生氧化反应
B.该电池放电时NO3-向石墨Ⅱ电极迁移
C.石墨Ⅰ附近发生的反应:3NO2 +2e-=NO+ 2NO3-
D.相同条件下,放电过程中消耗的NO2和O2的体积比为4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH–+2H2O=2![]() 。下列说法正确的是( )
。下列说法正确的是( )
A.放电时,电解质溶液中K+向负极移动
B.放电时,电解质溶液中c(OH-)逐渐增大
C.放电时,负极反应为:Zn+4OH--2e-=![]()
D.放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.用浓盐酸酸化的KMnO4溶液氧化H2C2O4:6H++5H2C2O4+2MnO4-=10CO2↑+2Mn2++8H2O
B.向Ca(HCO3)2溶液中滴加入少量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C.向Fe(NO3)3溶液中加入过量的HI溶液:2NO3-+8H++6I-=3I2+2NO↑+4H2O
D.用石墨电极电解MgCl2溶液:Mg2++2Cl-+2H2O![]() Mg(OH)2↓+H2↑+Cl2↑
Mg(OH)2↓+H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
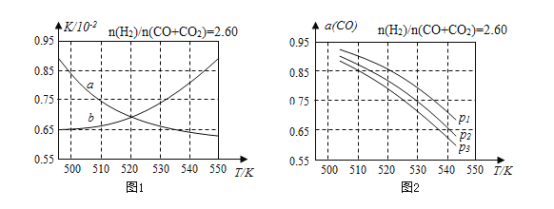
【题目】甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)CH3OH(g)△H1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)CO(g)+H2O(g)△H3
回答下列问题:
(1)已知△H1=﹣99kJ·mol﹣1,已知△H2=﹣58kJ·mol﹣1,则△H3=______kJ·mol﹣1。
(2)反应①的化学平衡常数K的表达式为______;图1中能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母)。
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示。a(CO)值随温度升高而________(填“增大”或“减小”)图2中的压强由大到小为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:①N2(g)+O2(g)=2NO(g) ΔH=180.5 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ· mol-1
③2C(s)+O2(g)= 2CO(g) ΔH=-221 kJ· mol-1
若某反应Ⅰ的平衡常数表达式为K=![]() 请写出此反应的热化学方程式:________,该反应自发进行的条件是_________。
请写出此反应的热化学方程式:________,该反应自发进行的条件是_________。
(2)一定温度下,向体积为V L的密闭容器中充入一定量的NO和CO,发生反应Ⅰ。
①下列说法正确的是____。
A 当容器内气体压强不再发生变化时,说明反应已达到平衡状态
B 当v(CO2)=v(CO)时,说明反应已达到平衡状态
C 达到平衡后,若向容器中再充入一定量NO,则NO转化率将减小
D 达到平衡后,若再升高温度,由于逆反应速率增大,正反应速率减小,因此平衡向逆反应方向移动
②若反应在t1时刻达到平衡状态,在其他条件不变的情况下,t2时刻通过缩小容器体积使压强增大到原来的2倍,t3时刻达到新的平衡状态。请在图中补充画出t2~t4时段c(NO)的变化曲线: ____

(3)分离高炉煤气得到的CO与空气可设计成燃料电池而除去(以KOH溶液为电解质溶液)。写出该电池的负极反应式:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com