
【题目】现代技术可利用电解法制H2O2并用产生的H2O2处理废氨水,其装置如图所示。下列说法正确的是( )
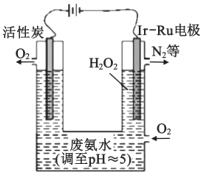
A.该过程的总反应为:3H2O2+8H++4NH3H2O=8H2O+N2↑+2NH4+
B.Ir-Ru惰性电极有吸附O2的作用,该电极上的反应为:O2+2H++2e-=H2O2
C.理论上电路中每转移6mol电子,最多可以处理NH3H2O的物质的量为1mol
D.为了不影响H2O2的产量,需要向废氨水中加入适量硝酸调节溶液的pH约为5,则所得的废氨水溶液中c(NH4+)>c(NO3-)
【答案】B
【解析】
根据装置图可得,活性炭与电源正极相连,则活性炭为阳极,Ir-Ru惰性电极为阴极,电解液为酸性,阳极上为阴离子放电,则OH-离子放电生成氧气,阳极电极反应为4OH--4e-=O2↑+2H2O,阴极上通入氧气生成H2O2,阴极电极反应为:O2+2H++2e-=H2O2,据此分析解答。
A.根据分析,阳极电极反应为4OH--4e-=O2↑+2H2O,阴极电极反应为:O2+2H++2e-=H2O2,电解池的总反应为:2H2O+O2=2H2O2,双氧水处理氨水,反应为:3H2O2+2NH3= N2↑+6H2O,两式合并,则该过程的总反应为:4NH3+3O2=2N2+6H2O,故A错误;
B.利用电解法制H2O2,在该电解池中,Ir-Ru惰性电极有吸附O2作用为氧气得电子发生还原反应,该电极上的反应为: O2+2H++2e-=H2O2,故B正确;
C.根据分析,该过程的总反应为:4NH3+3O2=2N2+6H2O中,氨气中的氮元素从-3价变为氮气中的0价,4mol氨气转移12mol电子,所以理论上电路中每转移6mol电子,最多可以处理NH3H2O的物质的量为2mol,故C错误;
D.向废氨水加入适量硝酸调节溶液的pH约为5,根据溶液呈电中性,溶液中存在电荷守恒:c(NH4+)+c(H+)=c(NO3)+c(OH),pH约为5呈酸性,c(H+)>c(OH),所以c(NH4+)<c(NO3),故D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】设![]() 表示阿伏加德罗常数的值,下列说法正确的是( )
表示阿伏加德罗常数的值,下列说法正确的是( )
A.常温下![]() 的
的![]() 溶液中
溶液中![]() 与
与![]() 数目均为
数目均为![]()
B.![]() 葡萄糖和果糖的混合物中含羟基数目为
葡萄糖和果糖的混合物中含羟基数目为![]()
C.![]() 与足量
与足量![]() 反应,生成
反应,生成![]() 和
和![]() 的混合物,Na失去
的混合物,Na失去![]() 个电子
个电子
D.室温下,![]() 的
的![]() 溶液中,由水电离的
溶液中,由水电离的![]() 数目为
数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图乙是根据图甲的电解池进行电解时某个量(纵坐标x)随时间变化的函数曲线(各电解池都用石墨作电极,不考虑电解过程中溶液浓度变化对电极反应的影响),这个量x是表示( )
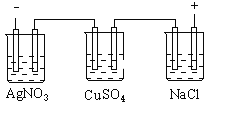
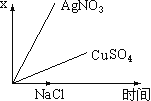
甲 乙
A. 各电池析出气体体积总数的变化B. 各电解池阳极质量的增加
C. 各电解池阴极质量的增加D. 各电极上放电的离子总数的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有25 mL 2 mol·L-1Na2CO3和75 mL 1 mol·L-1的稀盐酸:①将Na2CO3溶液缓缓滴到稀盐酸中 ②将稀盐酸缓缓滴到Na2CO3溶液中,在标准状况下产生气体的体积情况( )
A.均为0.84 L
B.均为0.56 L
C.①>②
D.②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用情性电极电解100ml0.5mol/L的CuSO4溶液、当阳极产生1.12L(标准状况)气体时,若要使电解质溶液恢复到电解前的状态,需加入的物质是( )
A. CuCO3B. CuOC. Cu(OH)2D. CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1906年,哈伯在60℃高温、200兆帕高压的条件下,用锇(Os)作催化剂,首次成功得到了氨,但产率较低。随着科学的进步以及科学家们对催化剂的研究改进,现在工业上普遍采用铁触媒(主要成分为Fe3O4,助催化剂:K2O、Al2O3、CaO、MgO、CoO等)做合成氨的催化剂,大大提高了合成氨的产率。回答下列问题:
(1)已知元素Co(钴)的原子核内有27个质子,则该元素基态原子价电子排布式为___。
(2)元素Fe的基态原子核外未成对电子数为___;Fe2+与Fe3+相比较,___更稳定。
(3)C、N、O处于同一周期,其中第一电离能最大的___,电负性最大的是___,它们与氢形成的简单氢化物沸点从高到低的顺序为___。
(4)NH3分子中N原子的杂化方式为___;氨气极易溶于水(溶解度1:700),除了氨气能与水发生反应外,还有两个原因分别是___、___。
(5)我国长征系列运载火箭使用的液态燃料主要是偏二甲肼[结构简式:(CH3)2NNH2,可看作是肼(NH2NH2)中同一氮原子上的两个氢原子被甲基取代]和四氧化二氮,燃烧时发生反应:(CH3)2NNH2+2N2O4=2CO2+4H2O+3N2。当该反应消耗1molN2O4时将形成___molπ键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜铁及其化合物在日常生活和工业生产中有着重要用途。
(1)铁制炊具在潮湿的空气中易发生吸氧腐蚀而生锈,负极的电极反应式为:___,正极的电极反应式为:___。
(2)下列哪些装置可防止铁棒被腐蚀___。(填正确答案标号)
A.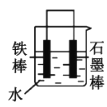 B.
B.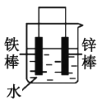 C.
C.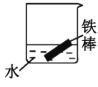 D.
D.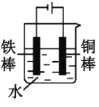
(3)高铁酸钾(K2FeO4)广泛应用于净水、电池工业等领域。工业上以钛白粉生产的副产品FeSO4制备高铁酸钾的生产流程如图:
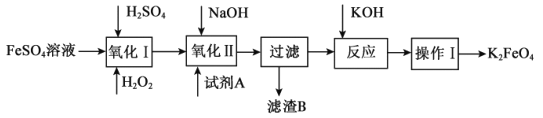
查阅资料:K2FeO4在水中溶解度很大,在碱性环境中稳定,在中性和酸性条件下不稳定。
①“氧化I”中,生成Fe3+的离子反应方程式是___。
②净水时高铁酸钾能逐渐与水反应生成絮状的Fe(OH)3,请补充并配平该反应方程式: K2FeO4+ H2O= Fe(OH)3↓+ KOH+ 。___。
(4)工业上常以铜做阳极,石墨做阴极,电解含有NaOH的NaCl水溶液制备Cu2O。
已知:该电解过程中阳极先生成难溶物CuCl,再与NaOH反应转化为Cu2O。
①写出阳极的电极反应式___,该过程中生成Cu2O的离子反应方程式为___。
②如果电解后溶液体积未发生变化,电解后溶液中的c(OH-)会___(填“变大”“变小”或“不变”)。
③若电解时电路中通过0.2mol电子,理论上生成Cu2O的质量为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y是一种药物中间体,可由X制得:
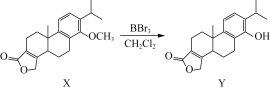
下列有关化合物X、Y的说法正确的是( )
A.Y分子中五元环上的4个碳原子一定共平面
B.1 mol X最多能与2 mol Br2反应
C.用FeCl3溶液可鉴别化合物X和Y
D.X、Y在酸性条件下的水解产物均能发生氧化反应、加成反应、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
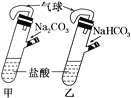
A.分别在甲乙两支侧管中装入1.06gNa2CO3和0.84gNaHCO3,试管中各有10mL相同浓度的盐酸(如图)同时将两个侧管中的物质全部倒入各自的试管中,乙装置的气球膨胀速率大
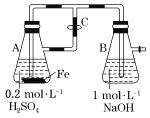
B.用如图装置可以制备沉淀Fe(OH)2
C.取少量Fe(NO3)2试样加水溶解,加稀H2SO4酸化,滴加KSCN溶液,溶液变为红色。结论:该Fe(NO3)2试样已经变质
D.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液充分反应,过滤,向滤液中通入过量CO2后过滤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com