
已知多元弱酸在水溶液中的电离是分步进行的,且第一步电离的程度远大于第二步电离的程度,第二步电离的程度远大于第三步电离的程度……
今有HA、H2B、H3C三种弱酸,根据“较强酸+较弱酸盐→较强酸盐+较弱酸”的反应规律,它们之间 能发生下列反应:①HA+HC2-(少量)=A-+H2C-;②H2B(少量)+2A-=B2-+2HA;③H2B(少量)+H2C-=HB-+H3C。回答下列问题:
能发生下列反应:①HA+HC2-(少量)=A-+H2C-;②H2B(少量)+2A-=B2-+2HA;③H2B(少量)+H2C-=HB-+H3C。回答下列问题:
(1)相同条件下,HA、H2B、H3C三种酸中酸性最强的是________。
(2)A-、B2-、C3-、HB-、H2C-、HC2-六种离子中最易结合质子的是__________,最难结合质子的是___________。
(3)下列离子方程式中正确的是________。
A. H3C+3A-=3HA+C3-
H3C+3A-=3HA+C3-
B.HB-+A-=HA+B2-
C.H3C+B2-=HB-+H2C-
(4)完成下列反应的离子方程式:
H3C+OH-(过量)→_________;
HA(过量)+C3-→__________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016届浙江省嘉兴、杭州、宁波五校高三上第一次联考化学试卷(解析版) 题型:填空题
已知H2CO3的Ka1=4.2×10-7 、Ka2=5.6×10-11;HClO的Ka=3.0× 10-8,
HF的Ka=3.5×10-4 。
(1)NaClO溶液中通入少量CO2发生反应的离子方程式为 。
(2)在饱和氯水中加入NaHCO3,直至溶液的黄绿色褪去,则发生反应的离子方程式为 。
(3)常温下,将pH和体积都相同的氢氟酸和次氯酸分别加蒸馏水稀释,pH随溶液体积变化如图所示。
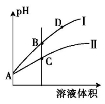
①曲线Ⅰ为 稀释时pH的变化曲线。
②取A点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗 体积较小。
(4)25 ℃时,将0.40 mol·L-1 HCN溶液与0.20 mol·L-1 NaOH溶液各100 mL混合后,测得溶液的pH=a(a>7)。则该溶液中所有离子浓度大小关系为 ;
c(HCN)-c(CN-)= mol·L-1。(假设混合后体积等于两种溶液体积之和)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东广州执信中学高二上期中文化学试卷(解析版) 题型:?????
有人分析一些有机化合物的样品,发现它们含有碳、氢、氧、氮等元素,这些样品很可能是( )
A.脂肪 B.氨基酸 C.葡萄糖 D.淀粉
查看答案和解析>>
科目:高中化学 来源:2016届浙江临海台州中学高三上学期第三次统练化学试卷(解析版) 题型:选择题
在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失。下列判断不正确的是
A.氧化性:ClO﹣>I2>SO42﹣
B.漂白粉溶液可使淀粉碘化钾试纸变蓝
C.次氯酸钠可以与亚硫酸钠共存
D.向氯水中加入亚硫酸钠溶液,氯水褪色
查看答案和解析>>
科目:高中化学 来源:2016届河北正定中学高三上学期第五次月考理科综合化学试卷(解析版) 题型:选择题
现有两种短周期主族元素X、Y,且在常温下X的单质呈气态,Y的单质呈固态。则下列推断不正确的是
A.若X、Y位于第ⅠA族,则X、Y可能与氧元素形成原子个数比为1:1或2:1的化合物
B.若X、Y位于第三周期,则X、Y形成的化合物可能是离子化合物,也可能是共价化合物
C.若气态HnX的沸点高于HnY,则X、Y只能位于元素周期表的第ⅥA族
D.若X,Y位于周期表的同一周期,则最高价含氧酸的酸性可能是HnXOm>HaYOb
查看答案和解析>>
科目:高中化学 来源:2016届福建省三明市高三上学期第二次月考化学试卷(解析版) 题型:选择题
利用合成气 (主要成分为 CO、CO2和 H2)在催化剂的作用下合成甲醇,发生的主反应如下:
(主要成分为 CO、CO2和 H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1=-99kJ·mol-1
CH3OH(g) △H1=-99kJ·mol-1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3=+41kJ·mol-1
CO(g)+H2O(g) △H3=+41kJ·mol-1
已知反应①中的相关的化学键键能数据如下,则 C-H 键能和△H2分别是
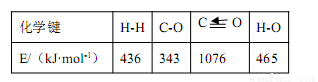
A.403 kJ·mol-1,-66 kJ·mol-1 B.423 kJ·mol-1,+28 kJ·mol-1
C.413 kJ·mol-1,-58 kJ·mol-1D.314 kJ·mol-1,-18 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016届安徽省合肥市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列离子方程式正确的是 ( )
A.亚硫酸氢铵溶液中滴加少量NaOH溶液:NH4++OH-=NH3.H2O
B.酸性KI淀粉溶液久置后变蓝4I-+O2+2H2O=2I2+4OH-
C.铜溶于稀硝酸中:Cu+4H++2NO3- = Cu2++2NO2↑+2H2O
D.NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建三明一中高一上学期第二次月考化学卷(解析版) 题型:选择题
下列有关试剂的保存方法,不正确的是
A.浓硝酸保存在棕色试剂瓶中
B.少量金属钠可保存在煤油里
C.新制氯水保存在棕色试剂瓶中
D.浓硫酸保存在橡胶塞试剂瓶中
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上期中测试化学试卷(解析版) 题型:填空题
向2L密闭容器中加入0.15 mol·L-1A、0.05 mol·L-1C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图中甲图所示[t0~t1时c(B)未画出,t1时增大到0.05 mol·L-1]。乙图为t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。

(1)若t4时改变的条件为减小压强,则B的起始物质的量为____________mol。
(2)若t5时改变的条件是升温,此时v(正)>v(逆),若A的物质的量减少0.03 mol时,容器与外界的热交换总量为a kJ,写出反应的热化学方程式:_______________________。
(3)t3时改变的某一反应条件可能是________(选填序号)。
A.t3时刻,增大了X的浓度 B.t3时刻,升高了体系温度
C.t3时刻,缩小了容器体积 D.t3时刻,使用了催化剂
(4)在恒温恒压下通入惰性气体,v(正)_________v(逆)(填“>”、“=”或“<”)。
(5)如图两个容器A、B中,A容器的容积保持不变,B容器保持和外界大气压一致。开始时,在保持两个容器体积相等的情况下,分别同时充入2moLH2S和1moLSO2。反应开始后两容器内反应平均反应速率A B (填“大于”、“小于”或“等于”)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com