
| Fe3+ | Cu2+ | Cr3+ | |
| ��ʼ����pH | 2.1 | 4.7 | 4.3 |
| ��ȫ����pH | 3.2 | 6.7 | a |
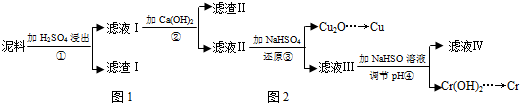
���� �������м���ϡ���ᣬ������ӦFe2O3+3H2SO4=Fe2��SO4��3+3H2O��CuO+H2SO4=CuSO4+H2O��Cr2O3+3H2SO4=Cr2��SO4��3+3H2O��Ȼ����˵õ�����I����ҺI����ҺI������ΪFe2��SO4��3��Cr2��SO4��3��CuSO4������Һ�м���Ca��OH��2����������ҺpH����������ͼ����ҺII�к���Cr3+��Cu2+������ Fe3+��˵������II�к���Fe��OH��3�����������������Գ���II�ɷ�ΪFe��OH��3��CaSO4��ҪʹCr3+��Cu2+��������Fe3+���������������������ɳ�����ҪpHֵ֪����Һ��pH��ΧΪ3.2-4.3֮�䣻����Һ�м���NaHSO3�����������ƾ��л�ԭ�ԡ�ͭ���Ӿ��������ԣ����߷���������ԭ��Ӧ���������ש��ɫ����Cu2O�������������������ӷ�Ӧ���ɶ����������ӷ���ʽΪ2H2O+HSO3-+2Cu2+=Cu2O��+SO42-+5H+��HSO3-+H+=SO2��+H2O�����˵õ�Cu2O������Һ�м���NaOH��������ҺpH��������ӦCr3++3OH-=Cr��OH��3������ҺIV�к���NaOH��Na2SO4���ݴ˷������
��� �⣺�������м���ϡ���ᣬ������ӦFe2O3+3H2SO4=Fe2��SO4��3+3H2O��CuO+H2SO4=CuSO4+H2O��Cr2O3+3H2SO4=Cr2��SO4��3+3H2O��Ȼ����˵õ�����I����ҺI����ҺI������ΪFe2��SO4��3��Cr2��SO4��3��CuSO4������Һ�м���Ca��OH��2����������ҺpH����������ͼ����ҺII�к���Cr3+��Cu2+������Fe3+��˵������II�к���Fe��OH��3�����������������Գ���II�ɷ�ΪFe��OH��3��CaSO4��ҪʹCr3+��Cu2+��������Fe3+���������������������ɳ�����ҪpHֵ֪����Һ��pH��ΧΪ3.2-4.3֮�䣻����Һ�м���NaHSO3�����������ƾ��л�ԭ�ԡ�ͭ���Ӿ��������ԣ����߷���������ԭ��Ӧ���������ש��ɫ����Cu2O�������������������ӷ�Ӧ���ɶ����������ӷ���ʽΪ2H2O+HSO3-+2Cu2+=Cu2O��+SO42-+5H+��HSO3-+H+=SO2��+H2O�����˵õ�Cu2O������Һ�м���NaOH��������ҺpH��������ӦCr3++3OH-=Cr��OH��3������ҺIV�к���NaOH��Na2SO4��
��1��ͨ�����Ϸ���֪����ҺI�����ʳɷ�ΪFe2��SO4��3��Cr2��SO4��3��CuSO4��
�ʴ�Ϊ��Fe2��SO4��3��Cr2��SO4��3��CuSO4��
��2��Fe3+��ȫ������Ҫ��pH��3.2��pH=4.3ʱCr3+��ʼ����������Ҫʹ��������ȫ�������������Ӳ���������pH��ΧΪ��3.2��pH��4.3��ͨ�����Ϸ���֪������II�ɷ�ΪFe��OH��3��CaSO4��
�ʴ�Ϊ��3.2��pH��4.3�� Fe��OH��3��CaSO4��
��3��������Ũ�ȡ�1��10-5mol•L-1ʱ��������Ϊ���ӳ�����ȫ����ҪʹCr3+��ȫ��������c��Cr3+����1��10-5mol•L-1��c��OH-��=$\root{3}{\frac{Ksp}{c��Cr{\;}^{3+}��}}$=$\root{3}{\frac{6.3��10{\;}^{-31}}{10{\;}^{-5}}}$mol/L=4.0��10-9 mol/L��c��H+��=$\frac{10{\;}^{-14}}{4.0��10{\;}^{-9}}$=2.5��10-6mol/L������Һ��pH=-lg2.5��10-6=5.6��
�ʴ�Ϊ��5.6��
��4��Cr2O3��Al�����·������ȷ�Ӧ������������Cr����Ӧ����ʽΪCr2O3+2Al$\frac{\underline{\;����\;}}{\;}$Al2O3+2Cr���ʴ�Ϊ��Cr2O3+2Al$\frac{\underline{\;����\;}}{\;}$Al2O3+2Cr��
���� ���⿼�����ʵķ�����ᴿ�ۺ�Ӧ�ã�Ϊ�߿���Ƶ�㣬�漰��������ܽ�ƽ�⡢����ұ��������ʵ�������֪ʶ�㣬���ؿ�����������㼰ʵ�������������Ϥ����ͼ���漰�ķ�Ӧ�������������ѵ����ܶȻ��������㣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���Ϸ�Ӧ | B�� | �ֽⷴӦ | C�� | �û���Ӧ | D�� | ���ֽⷴӦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ������ | �������� | ʵ������ | ʵ����� |
| �� | ��ˮ������ | ||
| �� | ��ˮ��Ư���� | ||
| �� | ��ˮ�д���Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ������ | H+��K+��Al3+��NH4+��Mg2+ |
| ������ | Cl-��Br-��OH-��CO32-��AlO2- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HCO3-��CO2 | B�� | MnO4-��Mn2+ | C�� | FeO��Fe3O4 | D�� | Cl-��Cl2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Fe2+��Na+��NO3-��Cl- | B�� | Ba2+��Na+��NO3-��Cl- | ||
| C�� | SO42-��SO32-��NH4+��Na+ | D�� | Mg2+��Na+��Br-��AlO2- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  ���Ȼ�����Һ�м�������İ�ˮ | |
| B�� |  ��ʯ��ˮ��ͨ�������CO2���� | |
| C�� |  ��MgCl2��AlCl3�Ļ��Һ����μ���NaOH��Һ������ | |
| D�� |  ������NaOH��ƫ��������Һ��ͨ�������HCl���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�11.2 L ˮ�к��еķ�����Ϊ0.5NA | |
| B�� | ��״���£�22.4LN2�к��е�ԭ����ΪNA | |
| C�� | 23g Na������H2O��Ӧת�Ƶĵ�����ΪNA | |
| D�� | ���ʵ���Ũ��Ϊ1 mol•L��1��K2SO4��Һ�У���2 NA��K+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ca2+��Fe2+��NO3-��HCO3- | B�� | H+��Ba2+��Cl-��NO3- | ||
| C�� | K+��AlO2-��Cl-��SO42- | D�� | Na+��Cl-��CO32-��SO32- |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com