
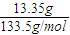 =0.1mol,完全生成Al(OH)3沉淀时,沉淀质量应为7.8g,现沉淀质量为3.9g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀,根据Al3++3OH-═Al(OH)3↓计算n(NaOH);
=0.1mol,完全生成Al(OH)3沉淀时,沉淀质量应为7.8g,现沉淀质量为3.9g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀,根据Al3++3OH-═Al(OH)3↓计算n(NaOH); =0.1mol,完全生成Al(OH)3沉淀时,沉淀质量应为7.8g,现沉淀质量为3.9g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,
=0.1mol,完全生成Al(OH)3沉淀时,沉淀质量应为7.8g,现沉淀质量为3.9g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,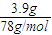 =0.05mol,
=0.05mol, =1.5mol/L,
=1.5mol/L,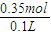 =3.5mol/L,
=3.5mol/L,

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013届江西省抚州市教研室高一上学期期末考试化学试卷 题型:填空题
(6分)含AlCl3 13.35g的溶液中加入一定浓度的NaOH溶液100mL后,结果得到沉淀3.9g。
(1)写出可能发生反应的离子方程式:
、
(2)上述NaOH溶液物质的量浓度可能是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2008-2009学年浙江省温州市高一(上)期末化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com