
| A. | 含4.5gAl | |
| B. | 一定不含FeCl2,可能含有MgCl2和AlCl3 | |
| C. | 含有物质的量相等的(NH4)2SO4和MgCl2 | |
| D. | 含有MgCl2和FeCl2 |
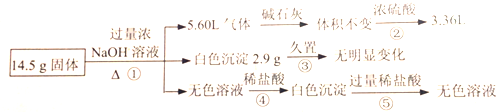
分析 14.5g固体加入过量的氢氧化钠溶液产生气体,有铵盐和碱反应生成生成的氨气,也可以是金属铝与氢氧化钠溶液反应生成氢气,5.60L气体通过碱石灰无变化,说明气体中无与碱石灰反应的气体,无水蒸气的存在,通过浓硫酸,气体剩余3.36L,体积减少5.60L-3.36L=2.24L,结合混合物可能存在的物质可知,一定含有硫酸铵与氢氧化钠反应生成氨气为2.24L,剩余的气体只能是氢气,体积为3.36L,说明原混合物中一定含有铝;
14.5g固体加入过量的氢氧化钠溶液中产生白色沉淀2.9g,久置无变化,由于氢氧化铝溶于强碱,所以能生成白色沉淀的一定氯化镁生成的氢氧化镁白色沉淀,质量为2.90g,一定不存在FeCl2;
14.5g固体加入过量的氢氧化钠溶液得到无色溶液,加入适量盐酸会生成沉淀,说明金属铝或氯化铝与过量碱反应生成的偏铝酸钠与盐酸反应生成的氢氧化铝沉淀,加入过量盐酸沉淀溶解进一步证明沉淀是氢氧化铝,以此解答该题.
解答 解:14.5g固体加入过量的氢氧化钠溶液产生气体,有铵盐和碱反应生成生成的氨气,也可以是金属铝与氢氧化钠溶液反应生成氢气,5.60L气体通过碱石灰无变化,说明气体中无与碱石灰反应的气体,无水蒸气的存在,通过浓硫酸,气体剩余3.36L,体积减少5.60L-3.36L=2.24L,结合混合物可能存在的物质可知,一定含有硫酸铵与氢氧化钠反应生成氨气为2.24L,剩余的气体只能是氢气,体积为3.36L,说明原混合物中一定含有铝;
14.5g固体加入过量的氢氧化钠溶液中产生白色沉淀2.9g,久置无变化,由于氢氧化铝溶于强碱,所以能生成白色沉淀的一定氯化镁生成的氢氧化镁白色沉淀,质量为2.90g,氢氧化铜为蓝色沉淀,所以固体混合物中一定不存在FeCl2;
14.5g固体加入过量的氢氧化钠溶液得到无色溶液,加入适量盐酸 会生成沉淀,说明金属铝或氯化铝与过量碱反应生成的偏铝酸钠与盐酸反应生成的氢氧化铝沉淀,加入过量盐酸沉淀溶解进一步证明沉淀是氢氧化铝,
A.固体混合物中一定含有Al,可以根据标况下3.36L氢气可以计算出铝的物质的量为0.1mol,质量为2.7g,故A错误;
B.根据以上分析可知,固体混合物中一定含有MgCl2,故B错误;
C.根据以上分析可知,原固体混合物中一定含有(NH4)2SO4、MgCl2,硫酸铵的物质的量为:$\frac{2.24L}{22.4L/mol}$×$\frac{1}{2}$=0.05mol,氯化镁的物质的量为:$\frac{2.9g}{58g/mol}$=0.05mol,所以二者的物质的量相等,故C正确;
D.根据加入氢氧化钠溶液后生成白色沉淀,且白色沉淀没有变化,则固体混合物中一定含有MgCl2,一定不含FeCl2,故D错误.
故选C.
点评 本题综合考查无机物的推断,涉及物质的检验和鉴别的实验方案的设计和评价,题目难度中等,侧重于物质化学性质的综合应用,注意把握相关物质的性质以及反应现象,结合生成物物质的质量以及反应现象进行推断.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强不再改变 | |
| B. | 单位时间内生成n mol A的同时,生成2n mol的B | |
| C. | C的生成速率是B 的生成速率的两倍 | |
| D. | 混合气体的密度不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧原子的原子结构示意图: | |
| B. | 羟基的结构式:O-H | |
| C. | 用电子式表示Na2O的形成过程: | |
| D. | 组成为C2H6O的分子中可能只存在极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 +12MnO${\;}_{4}^{-}$+36H+→
+12MnO${\;}_{4}^{-}$+36H+→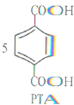 +12Mn2++28H2O.
+12Mn2++28H2O.| A. | PTA是该反应的氧化产物 | B. | 消耗1molPX,共转移8mol电子 | ||
| C. | PX含苯环的同分异构体还有3种 | D. | PTA与乙二醇可以发生缩聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | y=x%<$\frac{1}{2}$ | B. | y=1-x%>$\frac{2}{3}$ | C. | y=x%>$\frac{1}{3}$ | D. | y=1-2x%>$\frac{1}{3}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性酸:HNO3、H3PO4、HClO4 | |
| B. | 干燥剂:碱石灰、硅胶、无水氯化钙 | |
| C. | 酸性氧化物:SiO2、Cl2O、CrO3 | |
| D. | 危险化学品:天然气、金属钠、氯酸钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,l.6g${\;}_{6}^{14}$CH4中含有共价键总数为0.4NA | |
| B. | 密闭容器中2molNO与1molO2充分反应后,容器内气体的分子数为2NA | |
| C. | 1 L 0.lmol•L-1的CH3COONa溶液中CH3COO-和CH3COOH粒子数之和为0.1NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH=CH2 1,3-二丁烯 | |
| B. | CH3COOCH2CH2OOCCH3 乙二酸二乙酯 | |
| C. | CH3CH2CH(OH)CH3 3-丁醇 | |
| D. | 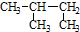 2-甲基丁烷 2-甲基丁烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com