
【题目】平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵:

己知:
I.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式;
II. CeO2不溶于稀硫酸;利用有机溶剂可分离稀土元素如Ce等化合物。
请按要求回答下列问题:
(1)Ce的原子序数为58,它位于元素周期表中第______周期。
(2)步骤①、⑥反应的化学方程式分别为_________________、______________。
(3)检验滤渣B洗涤干净的方法是____________________。
(4)步骤③的离子方程式为____________________。
(5)操作X名称为_________________。
(6)在滤液B中加过量铁粉于50 °C水浴中加热充分反应后趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口,静置、冷却一段时间后收集得产品绿矾。
步骤②中的硫酸溶液过稀会导致____________;静置冷却一段时间后,在试管中观察到的现象是______________________。
(7)取2.08 g产品Ce(OH)4加过量稀硫酸溶解后,用0.1000 mol/L FeSO4溶液滴定至终点共消耗90.00mL,则产品中Ce(OH)4的质量分数为______________。
【答案】 6 2NaOH+SiO2=Na2SiO3+H2O 4Ce(OH)3+O2+2H2O= 4Ce(OH)4 取少量最后一次洗涤液于试管中,滴加几滴KSCN溶液,若不出现红色,则己洗净 2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O 萃取分液 反应速率慢、不利于晶体析出 有浅绿色晶体析出 90%
【解析】以废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)为原料回收Ce(OH)4和硫酸铁铵的工艺流程为:第①步反应废玻璃粉末加氢氧化钠溶液后过滤,得到滤渣A的成分是Fe2O3、CeO2、FeO,二氧化硅与氢氧化钠反应生成硅酸钠,溶于水;滤渣A(Fe2O3、CeO2、FeO)加稀硫酸后过滤得滤液B是硫酸铁、硫酸亚铁溶液,滤渣B的成分是CeO2;第③步反应CeO2与H2O2和稀H2SO4反应生成Ce3+和O2;第④步是用有机溶剂将Ce3+萃取出来,通过分液操作可得有机层含有Ce3+,第⑤步用某试剂进行反应萃取,得浓的Ce3+溶液,第⑥步浓的Ce3+溶液中加碱,再用氧气氧化得Ce(OH)4,据此分析解答。
(1)Ce的原子序数为58,根据元素周期表可知,它位于元素周期表中第六周期;(2)根据上面的分析可知,步骤 ①反应的化学方程式为2NaOH+SiO2=Na2SiO3+H2O,步骤 ⑥反应的化学方程式为4Ce(OH)3+O2+2H2O= 4Ce(OH)4;(3)滤渣B的表面有可能的杂质为铁离子,所以检验滤渣B洗涤干净的方法是取少量最后一次洗涤液于试管中,滴加几滴KSCN溶液,若不出现红色,则已洗净;(4)根据上面的分析可知,步骤 ③的离子方程式为2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O;(5)根据上面的分析可知,操作X名称为萃取分液;(6)步骤 ②中的硫酸溶液过稀会导致反应速率慢、不利于晶体析出,在滤液B中加过量铁粉于50℃水浴中加热充分反应后趁热过滤,可以减少FeSO4的损失。静置冷却一段时间后,在试管中观察到的现象是有浅绿色晶体析出;(7)FeSO4的物质的量为0.1000mol/L×90.00mL×10-3=9.0×10-3mol,根据电子得失守恒有关系式FeSO4~Ce(OH)4,所以取2.08g产品中Ce(OH)4的质量为9.0×10-3mol×208g/mol=1.872g,所以产品中Ce(OH)44的质量分数为1.872g/2.08g×100%=90%。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】下列物质中属于电解质的是:属于非电解质的是 . 能导电的是 . ①CO2 ②NaOH 固体 ③NaHCO3固体 ④C12H22O11(蔗糖) ⑤H2SO4溶液 ⑥铁.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
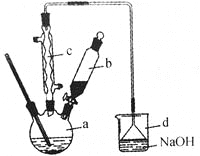
苯 | 溴 | 溴苯 | |
密度/g﹒cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了 气体。继续滴加至液溴滴完,装置d的作用是 ;
(2)液溴滴完后,经过下列步骤分析提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤,NaOH溶液洗涤的作用是 ;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为 ,要进一步提纯,下列操作中必须要做的是 (填入正确操作前的字母)
A.重结晶 B.过滤 C.蒸馏 D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于 aA(g)+bB(g)![]() cC(g)反应,改变某一变量(条件)得到如下图象(p 表示压强,T 表示温度,n 表示物质的量,á 表示平衡转化率)。根据图象,下列判断正确的是
cC(g)反应,改变某一变量(条件)得到如下图象(p 表示压强,T 表示温度,n 表示物质的量,á 表示平衡转化率)。根据图象,下列判断正确的是
A.反应 I:若 p1>p2,则 a+b<c
B. 反应Ⅱ:此反应的ΔH<0,且 T1<T2
C.反应Ⅲ:表示 t1 时刻一定是使用催化剂对反应速率的影响
D.反应Ⅳ:表示 t1 时刻增大 B 的浓度对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青苹果汁遇碘溶液显蓝色,熟苹果汁能还原银氨溶液,这说明
A. 青苹果中只含淀粉不含糖类 B. 熟苹果中只含糖类不含淀粉
C. 苹果转熟时淀粉水解为单糖 D. 苹果转熟时单糖聚合成淀粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学分析中,常需用KMnO4标准溶液,由于KMnO4晶体在室温下不太稳定,因而很难直接配制准确物质的量浓度的KMnO4溶液。实验室一般先称取一定质量的KMnO4晶体,粗配成大致浓度的KMnO4溶液,再用性质稳定、相对分子质量较大的基准物质草酸钠[ Na2C2O4 相对分子质量=134.0 ]对粗配的KMnO4溶液进行标定,测出所配制的KMnO4溶液的准确浓度,反应原理为: 5C2O42-+2MnO4-+16H+===10CO2↑+2Mn2++8H2O以下是标定KMnO4溶液的实验步骤:
步骤一:先粗配浓度约为0.15mol/L的KMnO4溶液500mL。
步骤二:准确称取Na2C2O4固体mg放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70~80℃,用步骤一所配KMnO4溶液进行滴定。记录相关数据。
步骤三: 。
步骤四:计算得KMnO4溶液的物质的量浓度。
试回答下列问题:
(1)下左图为整个过程中可能使用的仪器的部分结构(有的仪器被放大),
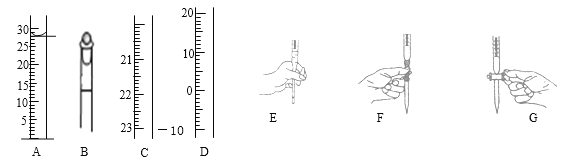
A图中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量某液体的体积,平视时读数为NmL,仰视时读数为MmL,若M>N,则所使用的仪器是 (填字母标号)。
(2)该滴定实验滴定终点的现象是 。
(3)步骤二中滴定操作图示(上右图)正确的是 (填编号)。
(4)步骤二的滴定过程温度变化并不明显,但操作过程中发现前一阶段溶液褪色较慢,中间阶段褪色明显变快,最后阶段褪色又变慢。试根据影响化学反应速率的条件分析,溶液褪色中间明显变快,最后又变慢的原因是 。
(5)请写出步骤三的操作内容 。
(6)若m的数值为1.340g,滴定的KMnO4溶液平均用量为25.00mL,则KMnO4溶液的浓度为 mol/L。
(7)若滴定完毕后读数时俯视,则实验误差为 (填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为合理利用“垃圾”资源,提倡垃圾分类回收,生活中废弃的铁锅、铝制易拉罐等可以归为一类加以回收,它们属于
A. 有机物 B. 无机盐 C. 金属或合金 D. 难溶性碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应A(s)+3B(g) ![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
A.①② B.④ C.③ D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3个SO32-恰好将2个XO4-离子还原,SO32-被氧化为SO42-,则X元素在还原产物中的化合价是( )
A.+1 B.+2 C.+3 D. +4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com