
【题目】利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂[主要成分为Al(OH)2Cl]的一种工艺如下:
(1)气体A能使湿润的红色石蕊试纸变蓝。铝灰在90 ℃水解生成A的化学方程式为_________________________________________。“水解”采用90 ℃而不在室温下进行的原因是_________________________________________________;
(2)“酸溶”时,Al2O3发生反应的离子方程式为_____________________;
(3)“氧化”时,发生反应的离子方程式为________________________________;
(4)“废渣”成分为________(填化学式);
(5)采用喷雾干燥而不用蒸发的原因是______________________________。
【答案】AlN+3H2O![]() Al(OH)3+NH3↑ 加快AlN水解反应速率;降低NH3在水中的溶解度,促使NH3逸出 Al2O3+6H+=2Al3++3H2O 2Fe2++2H++ClO-=2Fe3++Cl-+H2O Fe(OH)3 防止Al(OH)2Cl水解生成Al(OH)3
Al(OH)3+NH3↑ 加快AlN水解反应速率;降低NH3在水中的溶解度,促使NH3逸出 Al2O3+6H+=2Al3++3H2O 2Fe2++2H++ClO-=2Fe3++Cl-+H2O Fe(OH)3 防止Al(OH)2Cl水解生成Al(OH)3
【解析】
(1) 气体A能使湿润的红色石蕊试纸变蓝,说明A为NH3,则表示AlN发生了水解反应,控制温度90 ℃而不在室温下进行是因为NH3极易溶解于水,升温可降低其溶解促进NH3逸出。故答案为:AlN+3H2O![]() Al(OH)3+NH3↑,加快AlN水解反应速率;降低NH3在水中的溶解度,促使NH3逸出。
Al(OH)3+NH3↑,加快AlN水解反应速率;降低NH3在水中的溶解度,促使NH3逸出。
(2)“酸溶”时,Al2O3和酸发生了复分解反应,要注意Al2O3不可以拆分。离子方程式为Al2O3+6H+=2Al3++3H2O。
(3)因为溶液中唯一易氧化的离子是Fe2+,故为用漂白液氧化溶液中的Fe2+,离子方程式书写时要考虑溶液的酸性环境,结合电子守恒写出反应的离子方程式为:2Fe2++2H++ClO-=2Fe3++Cl-+H2O。
(4)“除杂”目的就是除去溶液中的Fe3+,因此很明显废渣为Fe(OH)3。
(5)加热蒸发会促进Al3+离子的水解,使Al3+离子最终水解为Al(OH)3。故答案为:防止Al(OH)2Cl水解生成Al(OH)3。


科目:高中化学 来源: 题型:
【题目】下列反应中,属于加成反应的是( )
A. CH2===CH2+H2![]() CH3CH3B.
CH3CH3B. ![]()
C. CH3CH2OH+3O2![]() 2CO2+3H2OD. CH3COOH+CH3CH2OH
2CO2+3H2OD. CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含amolNaClO的溶液通入bmolSO2充分反应(不考虑二氧化硫与水之间的反应以及次氯酸的分解)。下列说法不正确的是( )
A.当0<b<![]() 时:SO2+H2O+3ClO-=SO42-+2HClO+Cl-
时:SO2+H2O+3ClO-=SO42-+2HClO+Cl-
B.当b=a时:溶液的酸性明显增强
C.![]() ≤b≤a时:反应后溶液中H+的物质的量:0<n(H+)≤2bmol
≤b≤a时:反应后溶液中H+的物质的量:0<n(H+)≤2bmol
D.当0<b<![]() :SO2+H2O+2ClO-=SO32-+2HClO
:SO2+H2O+2ClO-=SO32-+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 按系统命名法,化合物 的名称是2,3,5,5-四甲基-4,4-二乙基己烷
的名称是2,3,5,5-四甲基-4,4-二乙基己烷
B. 等物质的量的苯与苯甲酸完全燃烧消耗氧气的量不相等
C. 苯不能使酸性KMnO4溶液褪色,但苯的同系物均可以
D. 结构片段为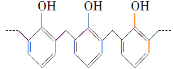 的高聚物,其单体是甲醛和苯酚
的高聚物,其单体是甲醛和苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列说法正确的是( )
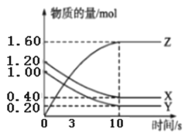
A.该反应的化学方程式为3X+Y![]() 2Z
2Z
B.3s时,正逆反应速率相等
C.平衡时X的浓度为0.40mol/L
D.10s时,该反应达到了最大限度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列问题
(1)硬脂酸甘油酯的结构简式____________
(2)用系统命名法命名 ![]() 为___________________
为___________________
(3)酸催化条件下制备酚醛树脂的化学方程式____________________________________________
(4)1,3-丁二烯与丙烯等物质的量发生加聚反应的化学方程式______________________________
(5)葡萄糖发生银镜反应的化学方程式_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰基丙烯酸酯在碱性条件下能快速聚合为![]() ,从而具有胶黏性。某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性。某种氰基丙烯酸酯(G)的合成路线如下:

已知:①A的相对分子质量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰。
②![]()
回答下列问题:
(1)A的化学名称为________________。
(2)B的结构简式为_____________,其核磁共振氢谱显示为_______组峰,峰面积比为_________。
(3)由C生成D的反应类型为__________。
(4)由D生成E的化学方程式为_________________________________________。
(5)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有____种。(不含立体异构)
(6)F与H2反应后生成C4H9NO2,此物质一定条件下发生聚合反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出前20号元素中的某些元素性质的一些数据:
元素 | A | B | C | D | E | F | G | H | I | J |
原子半径 (10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
最高价态 | +6 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
最低价态 | -2 | — | -2 | — | -4 | -3 | -1 | — | -3 | -4 |
试回答下列问题:
(1)以上10种元素中第一电离能最小的是____(填编号)。比元素B原子序数大10的元素在元素周期表中的位置:第____周期第____族,其基态原子的核外电子排布式是___________。
(2)由上述C、E、G三种元素中的某两种元素形成的化合物中,每个原子的最外层都满足8电子稳定结构的可能是____(写分子式,写出两种即可),元素G、I分别和J形成的两种化合物的晶体类型分别是_________、___________。
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。 其分子中共形成____个σ键,____个π键。
(4)短周期某主族元素K的电离能情况如图(A)所示。则K元素位于周期表的第_____周期、第____族。

图(B)是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第____族元素氢化物的沸点的变化规律。不同同学对某主族元素的氢化物的沸点变化趋势画出了两条折线——折线a和折线b,你认为正确的是____,理由是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在FeCl3和CuCl2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示。则该溶液中FeCl3与CuCl2的物质的量浓度之比为
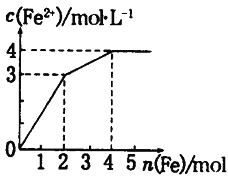
A. 3∶1 B. 1∶2 C. 2∶1 D. 1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com