
【题目】蓝宝石的主要成分为第ⅢA族元素的氧化物,该氧化物为( )
A.A12O3
B.CuO
C.Fe2O3
D.MgO
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】H2在O2中燃烧生成气态H2O的反应是一个放热反应,在反应过程中( )
A.核能转化成热能
B.化学能转化成热能
C.生成物的总能量等于反应物的总能量
D.生成物的总能量大于反应物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分离物质的方法中,不正确的是( )
A. 利用分馏的方法从石油中分离出汽油和煤油
B. 利用分液的方法将水和酒精分离
C. 利用结晶的方法除去硝酸钾中混有的少量氯化钠
D. 利用过滤的方法除去水中的泥沙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液.只用一种试剂就能加以区别,这种试剂是
A.KSCN B.BaCl2 C.NaOH D.HCI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)被称为21世纪的新型能源,它清洁、高效、具有优良的环保性能。
I.Ⅰ.工业制备二甲醚的生产流程如下:

催化反应室中(压力2.0~10.0Mpa,温度230~280℃)发生如下反应:
CO(g)+2H2(g)![]() CH3OH(g)△H=-90.7kJ/mol ①
CH3OH(g)△H=-90.7kJ/mol ①
2CH3OH(g)![]() CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol ②
CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol ②
CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=-41.2kJ/mol ③
CO2(g)+H2(g)△H=-41.2kJ/mol ③
(1)甲烷氧化可制得合成气,反应如下:CH4(g)+![]() O2
O2![]() CO(g)+2H2(g) △H=-35.6kJ/mol。该反应是_______反应(填“自发”或“非自发”)
CO(g)+2H2(g) △H=-35.6kJ/mol。该反应是_______反应(填“自发”或“非自发”)
(2)催化反应室中总反应3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g)的△H=______,830℃时反应③的K=1.0,则在催化反应室中反应③的K______1.0(填“>”、“<”或“=”)。
CH3OCH3(g)+CO2(g)的△H=______,830℃时反应③的K=1.0,则在催化反应室中反应③的K______1.0(填“>”、“<”或“=”)。
(3)上述反应中,可以循环使用的物质有________。
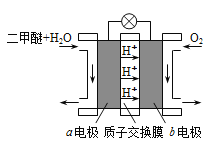
II.如图为绿色电源“二甲醚燃料电池”的工作原理示意图。b 电极是______极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应2A(g) ![]() B(g)+C(g)的平衡常数为1,在容积为2L的密闭容器中加入A(g)。20s时测得各组分的物质的量如下表:下列说法正确的是( )
B(g)+C(g)的平衡常数为1,在容积为2L的密闭容器中加入A(g)。20s时测得各组分的物质的量如下表:下列说法正确的是( )
物质 | A(g) | B(g) | C(g) |
物质的量/mol | 1.2 | 0.6 | 0.6 |
A.反应前20s的平均速率为v(A)=0.6mol·L-1·S-1
B.20s时,正反应速率等于逆反应速率
C.达平衡时,A(g)的转化率为100%
D.若升高温度,平衡常数将变为0.5,则反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:
(1)N2H4中N原子核外最外层达到8电子稳定结构.写出N2H4的结构式:___________.
(2)实验室用两种固体制取NH3的反应化学方程式为_____________.
(3)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为_____________.
(4)肼一空气燃料电池是一种碱性环保电池,该电池放电时,负极的反应式为_____________.
(5)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2]反应的化学方程式为2NH3(g)+CO2(g)CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
T/℃ | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
①焓变△H_________0(填“>”、“<”或“=”).
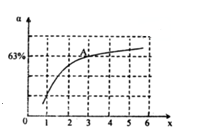
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)\frac{n(NH_{3})}{n(CO_{2})}=x,如图是氨碳比(x)与CO2平衡转化率(α)的关系.α随着x增大而增大的原因是_____________.图中A点处,NH3的平衡转化率为___________.
(6)在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料,发生反应:N2(g)+3H2(g)2NH3(g),测得甲容器中H2的平衡转化率为40%.
n(N2) | n(H2) | n(NH3) | |
甲 | 1mol | 3mol | 0mol |
乙 | 0.5mol | 1.5mol | 1mol |
丙 | 0mol | 0mol | 4mol |
①判断乙容器中反应进行的方向是_____________(填“正向或“逆向”)移动.
②达平衡时,甲、乙、丙三容器中NH3的体积分数大小顺序为_____________。
(6)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式: ,科学家利用此原理,设计成氨气一氧气燃料电池,则通入氨气的电极是
(7)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是 (填字母代号)。
4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是 (填字母代号)。
a.增大压强 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
(8)如果某氨水的电离程度为1%,浓度为0.01 mol/LMgCl2溶液滴加氨水至开始产生沉淀时(不考虑溶液体积变化),溶液中的NH3·H2O的浓度为 {已知Ksp[Mg(OH)2]=4.0×10-12]}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿酸的结构简式如图所示。下列有关说法正确的是( )
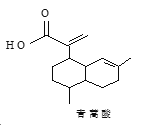
A.青蒿酸的分子式为C15H20O2
B.1mol青蒿酸最多可与3molH2加成
C.青蒿酸与![]() 互为同分异构体
互为同分异构体
D.苯环上连有-CHO和-OH、分子中有6种不同化学环境氢的青蒿酸的同分异构体只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是
A.W2-、X+ B.X+、 Y3+
C.Y3+、 Z2- D.X+、 Z2-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com