
| A. | ②⑤ | B. | ②⑥⑧ | C. | ②③⑤⑦⑧ | D. | ①②④⑤⑧ |
分析 升高温度、加入催化剂可增大活化分子的百分数,而增大压强、增大浓度,可增大单位体积活化分子的数目,但百分数不变,以此解答该题.
解答 解:①恒温时,增大压强,如没有气体参加反应,化学反应速率不加快,故错误;
②其他条件不变,温度越高,增大活化分子百分数,化学反应速率越快,故正确;
③使用催化剂不能改变反应热,故错误;
④温度未知,则3mol•L-1•s-1的反应速率不一定比1mol•L-1•s-1的反应速率大,故错误;
⑤升高温度能增大了反应物分子中活化分子的百分数,使化学反应速率增大,故正确
⑥有气体参加的化学反应,若增大压强(即缩小反应容器的体积),活化分子百分数不变,故错误;
⑦增大反应物浓度,活化分子的百分数不变,故错误;
⑧催化剂不参与反应,但能降低活化能降低活化分子的百分数,从而增大反应速率,故错误.
故选A.
点评 本题考查化学反应速率的影响因素,为高频考点,侧重于学生的分析能力的考查,注意外界条件对活化分子的影响,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | K+、Fe3+、Cl- | B. | Na+、CO32-、H+ | C. | Na+、HCO3-、OH- | D. | K+、AlO2-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压,22.4 SO3中的硫原子数目大于NA | |
| B. | 50g质量分数为34%的过氧化氢水溶液中含氧原子数目为NA | |
| C. | 5.6g Fe在0.1mol Cl2中充分燃烧,转移的电子数为0.3NA | |
| D. | 0.2mol AlCl3中含离子数为0.8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
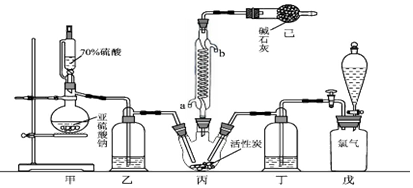
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量相等的O2和O3中所含原子数相等 | |
| B. | 物质的量相等的O2和O3中所含分子数相等 | |
| C. | 物质的量相等的CO和CO2中所含原子数相等 | |
| D. | 物质的量相等的CO和CO2中所含碳原子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2与足量的铁反应,转移的电子数为3NA | |
| B. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| C. | 标准状况下,2.24L已烷含有分子的数目为0.1NA | |
| D. | 常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
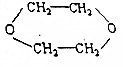 ,写出各步反应的化学方程式(一定要注明反应条件,有机物一定要写结构简式)(提示:电解食盐水可得NaOH,Cl2和H2)
,写出各步反应的化学方程式(一定要注明反应条件,有机物一定要写结构简式)(提示:电解食盐水可得NaOH,Cl2和H2)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com