
���� ��1��HCl��ǿ����ʣ�һˮ�ϰ���������ʣ�pH=3������Ũ��С��pH=11�İ�ˮŨ�ȣ����ߵ�������ʱ��ˮ��ʣ�࣬��Һ�ʼ��ԣ���Һ����������笠����Ӻ������ӡ��������������Ӻ����������ӣ���Һ����ѭ����غ㣻
��2��0.2mol•L-1 HR��Һ��0.1 mol•L-1 NaOH��Һ�������ϣ���Һ������Ϊ�����ʵ���Ũ�ȵ�HR��NaR����û����ҺpH��7����Һ�ʼ��ԣ�˵���������ˮ��̶ȴ���HR����̶ȣ��ٽ�ϵ���غ��ж�����Ũ�ȴ�С��
��3����������ˮ���룬���������ӵ��δٽ�ˮ���룻
��0.1mol•L-1MR��Һ��pH=10����ˮ�������c��H+��=c��OH-��=0.0001mol/L��
0.1mol•L-1HR��Һ��pH=3��HR��Һ��ˮ�������c��H+��=c��OH-��=10-11 mol/L��
�ɴ˼���ǰ��������Һ����ˮ����ı�ֵ��
��� �⣺��1��HCl��ǿ����ʣ�һˮ�ϰ���������ʣ�pH=3������Ũ��С��pH=11�İ�ˮŨ�ȣ����ߵ�������ʱ��ˮ��ʣ�࣬��Һ�ʼ��ԣ�����Һ��pH��7����Һ����������笠����Ӻ������ӡ��������������Ӻ����������ӣ���Һ����ѭ����غ�c��NH4+��+c��H+��=c��Cl-��+c��OH-�����ʴ�Ϊ������c��NH4+��+c��H+��=c��Cl-��+c��OH-����
��2��0.2mol•L-1 HR��Һ��0.1 mol•L-1 NaOH��Һ�������ϣ���Һ������Ϊ�����ʵ���Ũ�ȵ�HR��NaR����û����ҺpH��7����Һ�ʼ��ԣ�˵��R-ˮ��̶ȴ���HR����̶ȣ���c��OH-����c��H+�����ٽ�ϵ���غ��c��Na+����c��R-������ˮ��̶Ƚ�С��������Ũ�ȴ�С˳����c��Na+����c��R-����c��OH-����c��H+����
�ʴ�Ϊ������c��Na+����c��R-����c��OH-����c��H+����
��3����������ˮ���룬���������ӵ��δٽ�ˮ���룬0.2mol•L-1 HR��Һ��0.2mol•L-1 MOH��Һ�������ϣ�����ǡ����ȫ��Ӧ����MR����û����ҺpH��7��˵����ǿ�������Σ���MR�ٽ�ˮ���룬HR����ˮ���룬������Һ����ˮ�������c��H+����0.2mol•L-1HR��Һ����ˮ�������c��H+����
��0.1mol•L-1MR��Һ��pH=10����ˮ�������c��H+��=c��OH-��=0.0001mol/L��
0.1mol•L-1HR��Һ��pH=3��HR��Һ��ˮ�������c��H+��=c��OH-��=10-11 mol/L��
�ɴ˼���ǰ��������Һ����ˮ����ı�ֵ=10-4mol/L��10-11 mol/L=107��
�ʴ�Ϊ������107��
���� ���⿼���������Һ�����жϣ�Ϊ��Ƶ���㣬��ȷ��Һ�����ʳɷּ������ʡ������Һ������ǽⱾ��ؼ������ؿ���ѧ�����������������ѵ��Ǽ��㣨3����ˮ�����������Ũ�ȣ���Ŀ�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ʵ�鲽�� | ʵ������ | ʵ����� |
 | ��Һ��Ϊ��ɫ | �����ԣ�Cl2��Br2 |
 | ��Һ��Ϊ��ɫ | �����ԣ� Br2��I2 |
 | ��Һ����ɫ�ɻ�ɫ��Ϊ��ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
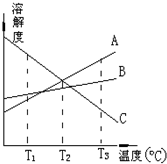
| A�� | T3��ʱ����A�������γɵ���Һ�����ʵ���Ũ����� | |
| B�� | T2��ʱ����A��C�������γɵ���Һ����������� | |
| C�� | T1��ʱ����B�������γɵ���Һ�����������C����С | |
| D�� | ���ܽ�����߿�֪����A��C�Ļ����Һ�õ�A�ɲ��������ᾧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1mol•L-1 | B�� | 1mol•L-1 | C�� | 3mol•L-1 | D�� | 1.5mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | A | B | C | D |
| Q | Na2O2 | SO2 | BaCl2 | AlCl3 |
| n | 1 | 1 | 4 | 2 |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
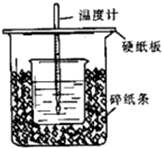 ��50mL0.50mol/L��������50mL0.55mol/L��NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺
��50mL0.50mol/L��������50mL0.55mol/L��NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���շϾ������Ǽ��١���ɫ��Ⱦ������Ч���� | |
| B�� | ���������Ǵ�������Ҫ��Ⱦ��֮һ | |
| C�� | ���������ƻ����������� | |
| D�� | �ӱ����������ǣ�δ���������ȼ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���糧��ú�������� | B�� | ��úת��Ϊˮú����ȼ�� | ||
| C�� | ��ʹ�����ϴ���һ������ĭ�ͺ� | D�� | ���᳧�ķ�Һ���кͺ�ֱ���ŷ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 3�� | B�� | 4�� | C�� | 5�� | D�� | 6�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com