
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:| t/K | 298 | 398 | 498 | … |
| K/(mol•L-1) | 4.1×106 | K1 | K2 | … |
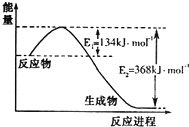
分析 (1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,根据热化学方程式书写原则进行书写;
(2)①根据焓变判断生成物反应物浓度的变化,然后根据平衡常数判断;
②根据平衡状态的判断依据判断;
(3)①由N2H4,联想到NH3,由N2H6Cl2联想到NH4Cl,再注意到N2H4是二元碱而NH3是一元的,根据铵根离子的水解产物是氨水和氢离子来书写水解方程式;
②盐酸肼水溶液中水解原理与NH4Cl类似,N2H62+离子水解溶液显酸性.
解答 解:(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,反应热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1,故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1;
(2)①该反应正反应是放热反应,升高温度,平衡向逆反应方向移动,生成物浓度减小,反应物浓度增大,所以K1>K2,故答案为:>;
②A、不同物质的正逆反应速率之比等于其计量数之比是平衡状态,能证明正逆反应速率相等,故A正确;
B、都体现正反应速率,未反映正与逆的关系,故B错误;
C、容器内压强不变,气体的物质的量不变,该反应达平衡状态,故C正确;
D、如果是在密闭容器中反应,质量不变,体积不变,密度始终不变,故D错误;
故选:AC;
(3)①盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似,由N2H4联想到NH3,由N2H6Cl2联想到NH4Cl,再注意到N2H6是二元碱而NH3是一元的,则盐酸肼第一步水解反应的离子方程式为N2H62++H2O?[N2H5•H2O]++H+;
故答案为:N2H62++H2O═[N2H5•H2O]++H+;
②盐酸肼水溶液中水解原理与NH4Cl类似,N2H62+离子水解溶液显酸性;
A、溶液中离子浓度大小为:c(Cl-)>c(N2H62+)>c(H+)>c(OH-),故A正确;
B、依据化学式可知N2H6Cl2,溶液中氯离子浓度大于N2H62+,故B错误;
C、电荷守恒可知:2c(N2H62+)+c([N2H5•H2O]+)+c(H+)═c(Cl-)+c(OH-),故C正确;
D、依据化学式可知N2H6Cl2,溶液中氯离子浓度大于N2H62+,故D错误;
故答案为:AC.
点评 本题考查了盐类水解的分析应用,电解质溶液中离子浓度大小比较方法,电荷守恒和质子守恒的分析判断,掌握基础注意类推应用是关键,题目难度中等.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:多选题
| A. | 等浓度时,若溶液中c(X-)=c(Y-)+c(HY),则乙的pH大 | |
| B. | 等浓度时,若甲的pH大,则甲中总离子浓度大 | |
| C. | 甲浓度大时,若溶液中c(X-)=c(Y-),则甲中水的电离程度大 | |
| D. | 乙浓度大时,若酸性HX强,则乙的水解程度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
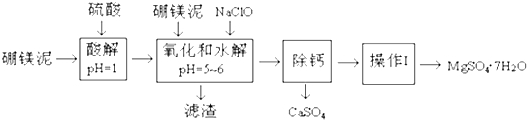
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
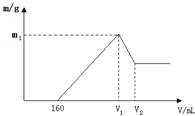 将镁铝的混合物0.1mol溶于100mL2mol/L硫酸溶液中,然后再滴加1mol/L氢氧化钠溶液,请回答以下问题:
将镁铝的混合物0.1mol溶于100mL2mol/L硫酸溶液中,然后再滴加1mol/L氢氧化钠溶液,请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
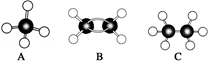 现有A、B、C三种烃,其球棍模型图:
现有A、B、C三种烃,其球棍模型图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用硫酸酸化高锰酸钾溶液,能起到增强氧化性作用 | |
| B. | 向某溶液中加入稀NaOH溶液未能产生使湿润的红色石蕊试变蓝的气体,说明原溶液中不含NH4+ | |
| C. | 在坩埚中加热MgCl2•6H2O晶体可以得到无水MgCl2 | |
| D. | 向某溶液中加入稀盐酸能产生使品红溶液褪色的气体,说明原溶液中一定含有SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
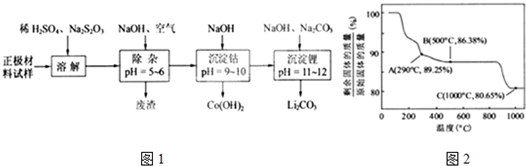
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
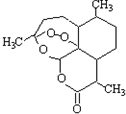
| A. | 分子式为:C16H22O5 | |
| B. | 该化合物中含有过氧键,一定条件下有氧化性 | |
| C. | 该化合物在一定条件下不能与NaOH溶液反应 | |
| D. | 该化合物与维生素一样是水溶性的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com