
| A. | 结构示意图 ,可以表示一种原子,也可以表示一种离子 ,可以表示一种原子,也可以表示一种离子 | |
| B. | 比例模型 可以表示二氧化碳分子,也可以表示二硫化碳分子分子 可以表示二氧化碳分子,也可以表示二硫化碳分子分子 | |
| C. | 电子式 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 | |
| D. | 分子式C2H4O2:可以表示乙酸,也可以表示甲酸甲酯 |
分析 A.结构示意图 ,只能表示氧离子;
,只能表示氧离子;
B.比例模型可以直观地表示分子的形状,注意原子半径的关系;
C.氢氧根离子带一个单位的负电荷;
D.分子式为C2H4O2,可能为CH3COOH或HCOOCH3.
解答 解:A. 原子序数为8,应为氧元素的粒子,由于质子数=8小于核外电子数10,故应为氧离子,故A错误;
原子序数为8,应为氧元素的粒子,由于质子数=8小于核外电子数10,故应为氧离子,故A错误;
B.比例模型 可以表示二氧化碳分子,但表示二硫化碳分子时错误,因碳原子半径小于硫原子半径,比例模型不正确,故B错误;
可以表示二氧化碳分子,但表示二硫化碳分子时错误,因碳原子半径小于硫原子半径,比例模型不正确,故B错误;
C.氢氧根离子的电子式为: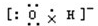 ,羟基的电子式为
,羟基的电子式为 ,故C错误;
,故C错误;
D.分子式为C2H4O2,可能为乙酸CH3COOH,也可以表示甲酸甲酯HCOOCH3,故D正确;
故选D.
点评 本题考查了常见化学用语,熟悉结构示意图、比例模型、电子式、同分异构体等知识即可解答,注意比例模型应符合原子的大小,题目难度不大.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有①正确 | B. | 只有②错误 | C. | ①③④正确 | D. | ①②③④⑤全错 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑥③ | B. | ①③⑥③ | C. | ②③④③ | D. | ②③⑤③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制取乙酸乙酯的主要步骤如下:
实验室制取乙酸乙酯的主要步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R的单质常温下跟水反应不如钠剧烈 | |
| B. | R的碳酸盐易溶于水 | |
| C. | R的原子半径比钾的原子半径小 | |
| D. | R的氢氧化物不能使氢氧化铝溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com