
 如图为以惰性电极进行电解:
如图为以惰性电极进行电解:

科目:高中化学 来源: 题型:
| ||
| A、148g/mol |
| B、24g/mol |
| C、74g/mol |
| D、40g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
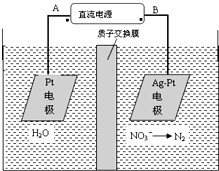 化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示.下列说法不正确的是( )
化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示.下列说法不正确的是( )| A、A为电源正极 |
| B、阳极反应式为:2H2O-4e-═4H++O2↑ |
| C、若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为10.4克 |
| D、阴极反应式为:2NO3-+6H2O+10e-=N2↑+12OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
| 2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
| 3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
| 4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
| 5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m4 |
| 6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
| 7 | 50.0 | 10.0 | 粉末 | 25 | t8 | 16.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 金属质量/g | 金属状态 | c(H2SO4) /mol?L-1 |
V(H2SO4) /mL |
溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 2 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 3 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 4 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 |
| B、分子式符合C5H11Cl的化合物有6种 |
| C、已知二氯苯有3种同分异构体,则四氯苯的同分异构体的数目为3种 |
D、菲的结构简式为 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com