
【题目】Ⅰ.氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
反应 | 大气固氮 N2(g)+O2(g) | 工业固氮 N2(g)+3H2(g) | |||
温度/℃ | 27 | 2000 | 25 | 400 | 450 |
K | 3.8×10﹣31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:大气固氮反应属于_____(填“吸热”或“放热”)反应。
②分析数据可知;人类不适合大规模模拟大气固氮的原因__________________________。
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(P1、P2)下随温度变化的曲线,如图所示的图示中,正确的是___(填“A”或“B”);比较P1、P2的大小关系:P1______P2(填“>”、“=” 或“<”)。

Ⅱ. 目前工业合成氨的原理是:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
(3)在一定温度下,将1mol N2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol。达平衡时,H2的转化率α1=____。
【答案】吸热 K值小,正向进行的程度小(或转化率低),不适合大规模生产 A < 60%
【解析】
(1)①温度越高,K越大,说明升高温度,平衡正移;
②K值很小,转化率很小;
(2)合成氨反应为放热反应,升高温度,转化率减小;增大压强平衡正向移动,转化率增大;
(3)列出三段式进行计算。
(1)①由表格数据可知,温度越高,K越大,说明升高温度,平衡正移,则正反应方向为吸热反应;
②由表格数据可知,2000℃时,K=0.1,K值很小,则转化率很小,不适合大规模生产,所以人类不适合大规模模拟大气固氮;
(2)合成氨反应为放热反应,升高温度,转化率减小,所以图A正确,B错误;该反应正方向为体积减小的方向,增大压强平衡正向移动,转化率增大,р2的转化率大,则р2大,P1<P2;
(3) N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
n始/mol 1 3
n变/mol x 3x 2x
n平/mol 1-x 3-3x 2x
平衡状态时,测得气体总物质的量为2.8mol
(1-x)+(3-3x)+2x=2.8mol
x=0.6mol
达平衡时,H2的转化率α1=![]() =60%。
=60%。


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是

A. 放电时,多孔碳材料电极为负极
B. 放电时,外电路电子由多孔碳材料电极流向锂电极
C. 充电时,电解质溶液中Li+向多孔碳材料区迁移
D. 充电时,电池总反应为Li2O2-x=2Li+(1-![]() )O2
)O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为___,该能层具有的原子轨道数为___。
(2)BF3与一定量的水形成(H2O)2BF3晶体Q,Q在一定条件下可转化为R:

晶体Q中各种微粒间的作用力有____(填序号)。
a 离子键 b 共价键 c 配位键 d 氢键
(3)第一电离能I1(Zn)___I1(Cu)(填“大于”或“小于”),原因是______。
(4)石墨烯(如图a)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图b)。
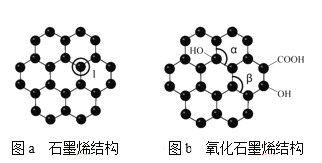
图a中,1号C与相邻C形成σ键的个数为____,图b中键角α___键角β。(填“>”、“<”或“=” );
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是形成光化学烟雾和酸雨的重要原因。人们研究了诸多有关氮氧化物的性质,请回答下列问题:
(1)处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) K1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) K2
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) K3
K1、K2、K3依次为三个反应的平衡常数,则K3=__(用K1、K2表示)。
(2)在恒容密闭容器中通入等物质的量的CO和NO,在一定条件下发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g),测得NO的平衡转化率与温度及压强的关系如图所示:
N2(g)+2CO2(g),测得NO的平衡转化率与温度及压强的关系如图所示:

①对于气相反应,用某组分(B)的平衡分压强p(B)代替物质的量浓度c(B)也可表示平衡常数kp,如果p1=1.65MPa,求a点的平衡常数kp=__(MPa)1(结果保留3位有效数字,分压=总压×物质的量分数)。
②为探究速率与浓度的关系,该实验中,根据相关实验数据,粗略绘制了2条速率—浓度关系曲线:v正~c(NO)和v逆~c(CO2)则:与曲线v正~c(NO)相对应的是图中曲线__(填“甲”或“乙”)。当降低反应体系的温度,反应一段时间后,重新达到平衡,v正和v逆相应的平衡点分别为___(填字母)。

(3)利用电化学原理,将NO2、O2和熔融的KNO3制成燃料电池,模拟工业电解法来处理含Cr2O72的废水,如图所示;电解过程中溶液发生反应:Cr2O72+6Fe2++14H+=2Cr3++6Fe3++7H2O。甲电池工作时,Y是气体,可循环使用。则石墨I附近发生的电极反应式为___。

(4)已知H3PO4为三元酸,Ka1=7.0×103mol·L1,Ka2=6.2×108mol·L1,Ka3=4.5×1013mol·L1。则Na2HPO4水溶液呈__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3COO+H+ ΔH>0。
CH3COO+H+ ΔH>0。
(1)常温常压下,在pH=5的稀醋酸溶液中,c(CH3COO)=__;(精确值)下列方法中,可以使0.10mol·L-1CH3COOH的电离程度增大的是___。
a.加入少量0.10mol·L1的稀盐酸 b.加热CH3COOH溶液 c.加入少量冰醋酸 d.加水稀释至0.010mol·L-1 e.加入少量氯化钠固体 f.加入少量0.10mol·L-1的NaOH溶液
(2)已知:90℃时,水的离子积常数为Kw=38×10-14,在此温度下,将pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=___(保留三位有效数字)。
(3)现有浓度均为0.1mol/L的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵 ⑤醋酸铵 ⑥硫酸铵 ⑦硫酸氢铵 ⑧氨水,请回答下列问题:
ⅰ.①、②、③、④四种溶液中由水电离出的H+的浓度由大到小的顺序是(填序号)__。
ⅱ.④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)___。
(4)一定条件下甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性炭可处理大气污染物NO。为模拟该过程,T℃时,在3L密闭容器中加入NO和活性炭粉,反应体系中各物质的量变化如下表所示。下列说法正确的是
活性炭/mol | NO/mol | X/mol | Y/mol | |
起始时 | 2.030 | 0.100 | 0 | 0 |
10min达平衡 | 2.000 | 0.040 | 0.030 | 0.030 |
A. X一定是N2,Y一定是CO2
B. 10min后增大压强,NO的吸收率增大
C. 10min后加入活性炭,平衡向正反应方向移动
D. 0~10min的平均反应速率v(NO)=0.002 mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)如图是1 mol NO2和1 mol CO反应生成CO2 和NO过程中的能量变化示意图,请写出NO2 和CO反应的热化学方程式 _________________________________________。

(2)在0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,其化学平衡常数 K 与温度 T 的关系如下表:
2NH3(g) ΔH<0,其化学平衡常数 K 与温度 T 的关系如下表:
T/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请回答下列问题:
①试比较K1、K2的大小,K1 ______ K2(填“>”、“=” 或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是_________(填序号字母)。
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.3v正(N2) = v逆(H2)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应 2NH3(g) ![]() N2(g) + 3H2(g) 的平衡常数K为_________。当测得NH3、N2、H2的浓度分别为3 mol L1、2 mol L1、1 mol L1时,则该反应的v正(N2)______v逆(N2)(填“>”、“=” 或“<”)。
N2(g) + 3H2(g) 的平衡常数K为_________。当测得NH3、N2、H2的浓度分别为3 mol L1、2 mol L1、1 mol L1时,则该反应的v正(N2)______v逆(N2)(填“>”、“=” 或“<”)。
(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-58 kJ·mol1),在其他条件不变时,温度T1、T2对反应的影响图像如图。
CH3OH(g)+H2O(g) ΔH=-58 kJ·mol1),在其他条件不变时,温度T1、T2对反应的影响图像如图。

①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=______mol·L1·min1。
②图示的温度T1______T2(填“>”、“=” 或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向一容积可变的密闭容量中充入2 mol X,发生反应:2X(g)![]() Y(g)+2Z(g),达到平衡后改变下述条件,气体Z的平衡浓度不变的是( )
Y(g)+2Z(g),达到平衡后改变下述条件,气体Z的平衡浓度不变的是( )
A. 恒温恒压下,充入1 mol X(g) B. 恒温恒容下,充入1 mol Y(g)
C. 恒温恒压下,充入2 mol Z(g) D. 恒温恒压下,充入1 mol He(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氨气可与灼热的氧化铜反应得到氮气和金属铜,用下图中的装置(省略夹持装置及加热装置)可以实现该反应。实验时C中粉末逐渐变为红色,D中出现无色液体。下列有关说法正确的是 ( )

A.试管A中加入的试剂为NH4Cl固体
B.反应中氧化剂和还原剂的物质的量之比为2 : 3
C.装置B中加入的物质可以是碱石灰或无水氯化钙
D.装置D中液体可以使干燥的红色石蕊试纸变蓝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com