
【题目】A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其它产物及反应条件已略去)。
![]()
(1)A、B、C、W均为气体,若A是无色有刺激性气味的气体, 气体B遇到空气变成红棕色。
①写出气体C溶于水的化学方程式______________;
②检验气体A的操作方法是______________;
(2)若A是一种黄绿色的气体,W是一种常见的金属单质。
①实验室制取气体A的离子方程式________________;
②B与W转化为C的离子反应方程式______________。
【答案】3NO2+H2O=2HNO3+NO 用湿润的红色石蕊试纸靠近气体,若试纸变为蓝色,就证明该气体为氨气 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 2Fe3++Fe=3Fe2+
Mn2++Cl2↑+2H2O 2Fe3++Fe=3Fe2+
【解析】
(1)A、B、C、W均为气体,若A是无色有刺激性气味的气体,气体B遇到空气变成红棕色,则B是NO,逆推气体A是NH3,气体W是O2,C是NO2;
(2)若A是一种黄绿色的气体,W是一种常见的金属单质,则A是Cl2,W是Fe。
(1) A、B、C、W均为气体,若A是无色有刺激性气味的气体,气体B遇到空气变成红棕色,则B是NO,逆推气体A是NH3,气体W是O2,C是NO2。
①NO2溶于水,与水反应产生HNO3和NO,反应的化学方程式为3NO2+H2O=2HNO3+NO;
②NH3溶于水使水溶液显碱性,所以检验气体A的操作方法是用湿润的红色石蕊试纸靠近,试纸变为蓝色,就证明该气体为氨气;
(2) 若A是一种黄绿色的气体,W是一种常见的金属单质,则A是Cl2,W是Fe。
①在实验室中用浓盐酸与MnO2混合加热制取Cl2,制取气体A的离子方程式是MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
②Fe与Cl2在点燃或加热时反应产生的B是FeCl3,向FeCl3溶液中加入Fe单质,反应产生的C是FeCl2,则B与W转化为C的离子反应方程式是2Fe3++Fe=3Fe2+。


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】镁条在空气中燃烧后,其生成物中可能含有的物质是
A.MgCO3、MgO、Mg3N2B.Mg(OH)2、MgO、MgCO3
C.MgO、Mg3N2、CD.Mg3N2、C、MgCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图的化学反应框图解图。
已知:粉末化合物A是红棕色,粉末单质B是金属单质

(1)单质F是________,溶液E加入氢氧化钠溶液的现象是_____________________;
(2)写出下列反应的化学方程式:
A+B→C+D_____________________________________;
D→H:_________________________________。
(3)写出下列反应的离子方程式:
E+Cl2→G:__________________;
G+C→E:________________________;
B→F+H:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯气体。
(1)请完成该过程的化学方程式并配平。______KClO3+_____HCl(浓) =____ KCl+_____ClO2↑+____Cl2↑+____H2O。
(2)浓盐酸在反应中显示出来的性质是 ________(填写编号)。
①氧化性 ②还原性 ③酸性 ④碱性
(3)若反应生成0.1 mol Cl2,则转移的电子数为________。
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)1kg ClO2相当于________kg Cl2。(提示:Cl2和ClO2在消毒过程中均变为Cl-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,需加入适当的还原剂才能完成的是
A. Cl-→Cl2 B. FeCl2 → FeCl3 C. CuO →Cu D. CO2→ Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G是元素周期表前四周期中常见的七种元素,其原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
A | A的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
B | B原子基态时s电子与p电子数目相同 |
C | C在组成化合物时没有正价 |
D | 常温常压下,D单质是淡黄色固体,常在火山口附近沉积 |
E | E和D同周期,E的电负性大于D |
F | F原子基态时未成对电子数是同周期中最多的 |
G | G的一种核素的质量数为63,中子数为34 |
(1)AB32-的立体构型为________,其中A的杂化轨道类型是_________________________;
(2)A22-与B22+互为等电子体,则B22+的电子式可表示为______________,1molB22+中含有共用电子对的数目为_____________;
(3)AD2是一种常用的溶剂,AD2的分子中存在___个π键。表中C、D、E三种元素分别与氢形成的共价键中,键长最大的是________(用具体元素符号组成的化学键表示)。
(4)下列有关A2H2的说法正确的是_____。
A.分子中所有原子都满足8电子稳定结构 B.每个分子中σ键和π键数目之比为2:3
C.它是由极性键和非极性键构成的分子 D.分子的空间构型为直线形
(5)写出G元素的原子核外电子排布式___________;工业上常通过在空气中煅烧G的低价含硫矿获得G单质,请写出该反应的方程式_____________________________;若往含有G2+的溶液中加过量氢氧化钠溶液,可生成Na2[G(OH)4]溶液,Na2[G(OH)4]具有的化学键类型有________。
A.离子键 B.极性共价键 C.非极性共价键 D.配位键
(6)表中F元素与Mn、Fe在工业上统称“黑色金属”,Mn、Fe 均为第 4 周期过渡金属元素,两元素的部分电离能数据列于下表:
元素 | Mn | Fe | |
电离能/kJmol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 4048 | 2957 | |
F元素为_____(填写元素名称);请写出基态 Mn2+的价电子轨道排布图____________________,比较两元素的 I2、 I3可知,气态 Mn2+再失去 1个电子比气态 Fe2+再失去 1个电子难,请解释原因__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在周期表中的相对位置如图所示。W、X、Y、Z原子的最外层电子数之和为21。下列说法中错误的是( )
![]()
A. 元素X的单质能与强酸、强碱反应B. 元素W、X与钠元素可形成化合物Na3XW6
C. 气态氢化物的稳定性:W>YD. 简单阴离子的还原性:W>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有以下物质: ①NaHSO4晶体②SO3③液态硫酸 ④铁⑤BaSO4固体⑥饱和FeCl3溶液⑦酒精(C2H5OH)⑧熔融的K2SO4,其中能导电的是__________,属于电解质的是__________,属于非电解质的是__________
(2)下列各组化学用语中:①3He、4He ② 2H2 O、1H2O ③ 1H、3H ④14N和13C质子数相同的有_________,中子数相同的有________,互为同位素的有________
(3)化学反应FeS+H2SO4(浓)![]() Fe2(SO4)3+SO2↑ +S↓ +H2O(未配平)中:氧化产物是:__________, 还原产物是:__________
Fe2(SO4)3+SO2↑ +S↓ +H2O(未配平)中:氧化产物是:__________, 还原产物是:__________
(4)请写出醋酸(CH3COOH)与氢氧化钠溶液反应的离子方程式_______
(5)盐酸可以除铁锈,请写出发生反应的离子方程式:__________
(6)工业上常用H2O2在酸性条件下氧化污水中的Fe2+,请写出离子方程式:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在含CH3COOH和CH3COO-的溶液中, CH3COOH、CH3COO-二者中各自所占的物质的量分数(a)随溶液pH变化的关系如图所示。
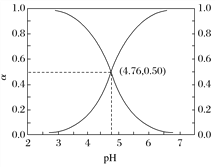
下列说法不正确的是
A. 在pH<4.76的溶液中,c(CH3COO-)<c(CH3COOH)
B. 在pH=7的溶液中,a(CH3COOH)=0,a(CH3COO-)=1.0
C. 在pH>4.76的溶液中,c(CH3COO-)与c(OH-)之和可大于c(H+)
D. 在pH=4.76的溶液中加盐酸,a(CH3COOH)与a(CH3COO-)之和保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com