
��֪�Ȼ�ѧ����ʽH2 (g) + F2 (g) ="==" 2 HF (g) ��H = ��270 kJ�� mol-1������˵���д������
| A�������������£�44.8 L����������ֽ��22.4 L������22.4 L��������270 kJ���� |
| B�������������£�1 mol������1 mol������Ӧ����2 molҺ̬������ų���������270 kJ |
| C�������������£�1 mol������ 1 mol�����������ܺʹ��� 2 mol��������������� |
| D�������Ȼ�ѧ����ʽ���ɱ�ʾΪ��1/2 H2 (g) +1/2 F2 (g)="==" HF (g) ��H = ��135 kJ�� mol-1 |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014���㽭ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪�Ȼ�ѧ����ʽH2 (g) + F2 (g) ="==" 2 HF (g) ��H = ��270 kJ�� mol-1������˵���д������
A�������������£�44.8 L����������ֽ��22.4 L������22.4 L��������270 kJ����
B�������������£�1 mol������1 mol������Ӧ����2 molҺ̬������ų���������270 kJ
C�������������£�1 mol������ 1 mol�����������ܺʹ��� 2 mol���������������
D�������Ȼ�ѧ����ʽ���ɱ�ʾΪ��1/2 H2 (g) +1/2 F2 (g)="==" HF (g) ��H = ��135 kJ�� mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
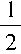 H2��g��+
H2��g��+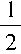 Cl2��g���Ħ�HΪ__________��
Cl2��g���Ħ�HΪ__________���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪�Ȼ�ѧ����ʽH2 (g) + F2 (g) === 2 HF (g) ��H = ��270 kJ�� mol-1������˵���д������
A�������������£�44.8 L����������ֽ��22.4 L������22.4 L��������270 kJ����
B�������������£�1 mol������1 mol������Ӧ����2 molҺ̬������ų���������270 kJ
C�������������£�1 mol������ 1 mol�����������ܺʹ��� 2 mol���������������
D�������Ȼ�ѧ����ʽ���ɱ�ʾΪ��
1/2 H2 (g) +1/2 F2 (g) === HF (g) ��H = ��135 kJ�� mol-1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com