
【题目】—定温度下,下列溶液的离子浓度关系式正确的是( )
A.稀释pH=3的醋酸,溶液中所有离子的浓度均降低
B.pH之和为14的H2C2O4与NaOH溶液混合:c(Na+)>c(H+)>c(OH-)>c(HC2O4-)
C.0.1mol/L的硫酸铵溶液中:c(SO42-)>c(NH4+)> c(H+)> c(OH-)
D.将等物质的量的Na2CO3和NaHCO3混合溶于水中:![]() <1
<1
【答案】D
【解析】
A、稀释pH=3的醋酸,溶液中氢离子的浓度降低,而氢氧根的浓度升高,故A错误;
B、pH之和为14的H2C2O4与NaOH溶液,H2C2O4溶液中的氢离子浓度等于NaOH溶液中的氢氧根浓度,而草酸是弱酸,所以草酸的物质的量浓度大于氢氧化钠溶液,反应后草酸远过量,溶液为H2C2O4与Na HC2O4混合溶液中,且H2C2O4更多,离子浓度大小顺序应该为:c(HC2O4-)>c(Na+)>c(H+)> c(C2O42-)>c(OH-),故B错误;
C、硫酸铵溶液中铵根离子浓度大于硫酸根离子浓度,铵根离子水解溶液显酸性,0.1 mol/L 的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-),故C错误;
D、将等物质的量的Na2CO3和NaHCO3混合溶于水中,碳酸根离子水解程度大于碳酸氢根离子,![]() <1,故D正确。
<1,故D正确。
答案选D。


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】一种药物中间体(G)的一种合成路线如图:

已知:
请回答下列问题:
(1)R的名称是__;R中官能团名称是__。
(2)M→N的反应类型是__。P的结构简式为__。
(3)H分子式是__。
(4)写出Q→H的化学方程式:__。
(5)T是一种与R具有相同官能团的芳香化合物(且组成元素种类相同),T的相对分子质量比R多14。T有__种结构。其中,在核磁共振氢谱上有5组峰且峰的面积比为1:1:2:2:2的结构简式可能有__。
(6)以1,5-戊二醇(![]() )和硝基苯为原料(其他无机试剂自选)合成
)和硝基苯为原料(其他无机试剂自选)合成![]() ,设计合成路线:__。
,设计合成路线:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取A、B两份物质的量浓度相等的NaOH溶液,体积均为50 mL,分别向其中通入一定量的CO2后,再分别稀释到100 mL,在稀释后的溶液中分别逐滴加0.1 mol/L的盐酸,产生的CO2的体积(标准状况)与所加盐酸的体积关系如图所示:

(1)原NaOH溶液的物质的量浓度_________________。
(2)B份混合溶液与盐酸反应产生气体的最大体积为________mL(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化钒(VO2)是一种新型热敏材料。实验室以V2O5为原料合成用于制备VO2的氧钒( IV )碱式碳酸铵晶体,过程如下:
V2O5![]() VOCl2溶液
VOCl2溶液![]() (NH4)5[(VO)6(CO3)4(OH)9]10·H2O
(NH4)5[(VO)6(CO3)4(OH)9]10·H2O
回答下列问题:
(1)步骤i中生成VOCl2的同时生成一种无色无污染的气体,该反应的化学方程式为____。也可只用浓盐酸与V2O5来制备VOCl2溶液,从环境角度考虑,该方法的缺点是_______。
(2)步骤ii可在如图装置(气密性良好)中进行。已知:VO2+能被O2氧化。

①药品填装完成后的实验操作是____(填活塞“a”“b”的操作)。
②若无装置B,则导致的后果是____。
(3)加完VOCl2后继续搅拌数分钟,使反应完全,小心取下分液漏斗,停止通气,立即塞上橡胶塞,将锥形瓶置于CO2保护下的干燥器中,静置过夜,得到紫红色晶体,抽滤,并用饱和NH4HCO3溶液洗涤3次,用无水乙醇洗涤2次,除去水分,再用乙醚洗涤2次,抽干称重。用饱和NH4 HCO3溶液洗涤除去的阴离子主要是____。
(4)测定氧钒( IV )碱式碳酸铵晶体粗产品中钒的含量。
称量4.246g样品于锥形瓶中,用20mL蒸馏水与30mL硫酸混合溶解后,加0.02 mol·L-1的KMnO4溶液至稍过量,充分反应后继续加1% NaNO2溶液至稍过量,再用尿素除去过量的NaNO2 ,最后用0.08 mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为30.00 mL。(滴定反应:VO2+ + Fe2++2H+=VO2++ Fe3++H2O)
①NaNO2溶液的作用是____。
②粗产品中钒的质量分数为____(精确到小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的有( )个
①20℃,101kPa,22.4LCl2通入足量的NaOH溶液充分反应,有NA个电子转移
②64g灼热的铜丝在硫黄蒸气里完全反应后,失去的电子数为2NA
③标准状况下,NA个NO分子和0.5NA个O2分子充分反应后气体体积为22.4 L
④7.8g Na2S与Na2O2的混合物中阴离子数大于0.1NA
⑤0℃,101kPa,含有lmol硫原子的SO2与SO3的混合物,其体积小于22.4L
⑥常温常压下,17g甲基(-14CH3)所含的中子数为9NA
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
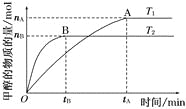
下列说法正确的是_______(填序号);
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
(2)在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以炼锌烟尘(主要成分为ZnO,含少量CuO和FeO)为原料,制取氯化锌晶体(ZnCl2·xH2O)的工艺流程如图:
已知:Zn及其化合物的性质与Al及其化合物的性质相似,pH>11时,Zn(OH)2能溶于NaOH溶液生成ZnO22-。
(1)碱溶时加入过量NaOH溶液的目的是___,发生反应的化学方程式是___。
(2)沉淀A的主要成分的化学式是___。
(3) “调pH”步骤中通入过量CO2,化学反应方程式___。
(4)酸溶时发生反应的离子方程式是___。
(5)一系列操作过程中的一系列操作是:___、___、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下:

下列说法不正确的是
A. b为电源的正极
B. ①②中,捕获CO2时碳元素的化合价发生了变化
C. a极的电极反应式为2C2O52 4e == 4CO2 + O2
D. 上述装置存在反应:CO2 ===== C + O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com