
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
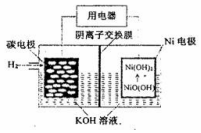
| A. | 放电时,OH-向碳电极迁移 | |
| B. | 放电时,负极反应NiO(OH)+H2O+e-=Ni(OH)2+OH- | |
| C. | 充电时,镍电极与电极的正极相连 | |
| D. | 充电时,碳电极区溶液pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ③④ | D. | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2SiO3溶液中逐滴加入少量稀盐酸:SiO32-+2H+═H2SiO3(胶体) | |
| B. | 将Cu片加入稀硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| C. | 向Na2S2O3溶液中加入稀硫酸:2S2O32-+2H+═SO42-+3S↓+H2O | |
| D. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-反应完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2,3,3一四甲基丁烷 | B. | 2,3,4一三甲基戊烷 | ||
| C. | 3,4一二乙基己烷 | D. | 2,2一二甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验次数 | 混合物的质量/g | 所加Ba(OH)2溶液的体积/L | 测得沉淀的质量/g |
| 1 | 0.858 | 0.5 | 1.379 |
| 2 | 1.716 | 0.5 | |
| 3 | 2.574 | 0.5 | 4.137 |
| 4 | 3.432 | 0.5 | 5.516 |
| 5 | 4.290 | 0.5 | 5.516 |
| 6 | 5.148 | 0.5 | 5.516 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成 分 | 质 量(g) | 摩尔质量(g/mol) |
| 蔗糖 | 50.00 | 342 |
| 硫酸钾 | 0.50 | 174 |
| 阿司匹林 | 0.35 | 180 |
| 高锰酸钾 | 0.50 | 158 |
| 硝酸银 | 0.04 | 170 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com