
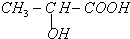 ,现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
,现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
 .
.分析 A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,与水发生加成反应生成CH3CH2OH,乙醇氧化生成CH3CHO,CH3CHO进一步氧化可得CH3COOH,CH3COOH与CH3CH2OH发生酯化反应生成CH3COOCH2CH3,则B为CH3CH2OH,C为CH3CHO,D为CH3COOH,结合有机物的结构和性质解答该题.
(1)A为乙烯,根据乙烯的电子式写出乙烯的结构式;
(2)E的结构简式为 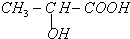 ,含有羟基、羧基官能团;
,含有羟基、羧基官能团;
(3)D为CH3COOH,E为乳酸,共有的官能团为羧基(-COOH),检验羧酸的性质;
(4)B→C为乙醛被氧化生成乙酸,反应类型为氧化反应;
(5)D为CH3COOH,D的一种同分异构体有香味且能在稀硫酸中水解,为甲酸甲酯.
解答 解:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,与水发生加成反应生成B为CH3CH2OH,B乙醇氧化生成C为CH3CHO,CH3CHO进一步氧化得到D为CH3COOH,CH3COOH与CH3CH2OH发生酯化反应生成CH3COOCH2CH3,
反应①:乙烯含有双键,可以和水发生加成反应生成乙醇,方程式为:CH2=CH2 +H2$→_{△}^{催化剂}$CH3CH2OH;
反应②:乙醇在Cu或Ag作催化剂条件下被氧化生成CH3CHO,反应的方程式为2CH3CH2OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O;
反应③:乙醛被氧化成乙酸,反应为:2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH;
反应④:乙酸和乙醇在浓硫酸作用下加热发生酯化或取代反应生成乙酸乙酯,反应的方程式为CH3COOH+CH3CH2OH 2CH3COOCH2CH3+H2O;
2CH3COOCH2CH3+H2O;
(1)A为CH2=CH2,电子式为 ,乙烯的结构式为
,乙烯的结构式为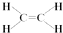 ,故答案为:
,故答案为: ;
;
(2)E的结构简式为 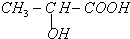 ,含有的官能团为羟基(-OH),含有官能团羧基(-COOH),
,含有的官能团为羟基(-OH),含有官能团羧基(-COOH),
故答案为:羟基;羧基;
(3)D为CH3COOH,含有官能团羧基(-COOH),E为乳酸,含有的官能团为羟基(-OH),含有官能团羧基(-COOH),共有的官能团为羧基(-COOH),羧酸的性质强于碳酸,检验羧酸的性质:用NaHCO3溶液或Na2CO3 溶液,能和羧基反应生成二氧化碳,或紫色石蕊试液,试液由紫色变红色说明溶液显酸性,
故答案为:NaHCO3溶液或Na2CO3 溶液或紫色石蕊试液(选其中一种也行,);产生无色无味的气体 (或试液由紫色变红色);
(4)乙醛中的醛基被氧化成羧基,B→C反应为:2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH,反应类型为氧化反应,
故答案为:2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH;氧化反应;
(5)D为CH3COOH,D的一种同分异构体有香味且能在稀硫酸中水解,为甲酸甲酯,结构简式为:HCOOCH3,
故答案为:HCOOCH3.
点评 本题考查有机物的推断,题目难度中等,本题注意衡量一个国家的石油化工水平的物质为乙烯,此为解答该题的关键之处,注意把握常见有机物的官能团和性质.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 用HA溶液做导电实验,灯泡很暗 | |
| B. | HA和CaCO3发生反应放出CO2 | |
| C. | pH=2的HA溶液稀释至100倍,pH小于4 | |
| D. | pH=3的HA溶液中水电离出的c(H+)为10-11mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 准确量取20.00mL高锰酸钾溶液,可选用25 mL碱式滴定管 | |
| B. | 将水加热,Kw增大,pH不变 | |
| C. | 用惰性电极电解1 L浓度均为2 mol/L的AgNO3与Cu(NO3)2的混合溶液,当有0.2 mol电子转移时,阴极析出6.4g金属 | |
| D. | CuSO4 的水溶液经加热浓缩、蒸干灼烧后能得到CuSO4固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
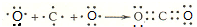 .
.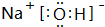 ,其中存在的化学键有离子键、共价键.
,其中存在的化学键有离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用图所示装置进行了有关实验:
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用图所示装置进行了有关实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.
W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com