
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 5.6g Fe在氧气中燃烧,完全反应时转移电子数为0.3NA
B. 标准状况下,22.4L氦气与22.4L氯气所含原子数均为2NA
C. 标准状况下,18g 水所含电子数目为10NA
D. 1molO2与足量Na反应,生成Na2O和Na2O2的混合物转移的电子数为 2NA
科目:高中化学 来源: 题型:
【题目】氯丁橡胶M是理想的电线电缆材料,工业上可由有机化工原料A或E制得,其合成路线如图所示。
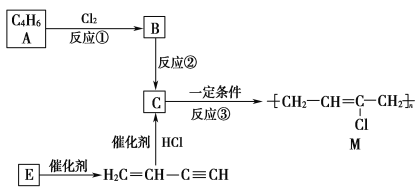
完成下列填空:
(1)A的名称是________________,反应③的反应类型是________。
(2)写出反应②的化学反应方程式:_____________________________________。
(3)为研究物质的芳香性,将E三聚、四聚成环状化合物,写出它们的结构简式:________________________。鉴别这两个环状化合物的试剂为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 1molCH4和4molCl2反应生成的有机物分子总数为4NA
B. 0.1molH35Cl中含有的质子数目或中子数目均为1.8NA
C. 常温下,22.4L乙烯中含有的共用电子对数目为6NA
D. 1molN2与足量H2发生合成氨反应时转移的电子数目为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘与氢气在一定条件下反应的热化学方程式如下:
(Ⅰ)I2(g)+H2(g)![]() 2HI(g) ΔH=-9.48 kJ·mol-1
2HI(g) ΔH=-9.48 kJ·mol-1
(Ⅱ)I2(s)+H2(g)![]() 2HI(g) ΔH=+26.48 kJ·mol-1
2HI(g) ΔH=+26.48 kJ·mol-1
下列判断正确的是( )
A. 在一定条件下将2 g H2(g)通入254 g I2(g)中,该过程放出的热量为9.48 kJ
B. 1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C. 反应(Ⅰ)的产物比反应(Ⅱ)的产物稳定
D. 物质的量相同时,反应(Ⅰ)的反应物总能量比反应(Ⅱ)的反应物总能量高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中产生的现象与对应的图形相符合的是( )
A. NaHSO3粉末加入HNO3溶液中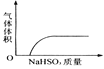 B. H2S气体通入氯水中
B. H2S气体通入氯水中
C. NaOH溶液滴入Ba(HCO3)2溶液中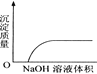 D. CO2通入澄清石灰水中
D. CO2通入澄清石灰水中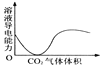
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有以下6个反应(反应条件略):
A.2Na+2H2O ═2NaOH+H2↑ B.CH4+2O2 ![]() CO2+2H2O
CO2+2H2O
C.KClO3![]() 2KCl+3O2↑ D.CaCO3+2HCl═CaCl2+H2O+CO2↑
2KCl+3O2↑ D.CaCO3+2HCl═CaCl2+H2O+CO2↑
E.Na2O+CO2 ═Na2CO3 F.CO2+C![]() 2CO
2CO
既属于化合反应又属于氧化还原反应的有__________(填编号,下同),不属于氧化还原反应的有__________.
(2)根据反应:①2Fe3++2I-===2Fe2++I2,②Br2+2Fe2+===2Fe3++2Br-,③ Br2+2I-===I2+2Br-,回答下列问题。
①试判断离子的还原性由强到弱的顺序是________
A.Br-、Fe2+、I- B.I-、Fe2+、Br- C.Br-、I-、Fe2+ D.Fe2+、I-、Br-
②某溶液中含有Br-、Fe2+、I-,为了氧化I-而不影响Br-和Fe2+,选用的氧化剂是__________;
③I2与Br-能否发生反应________
A.能 B.不能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求,回答下列问题:
(1)同温同压下,0.3mol氧气和0.2mol臭氧的质量比为____。
(2)某气体的质量为3.4g,含有6.02×1022个分子,则该气体的摩尔质量为____
(3)标准状况下,89.6LHCl气体溶于1L水(ρ=1g/mL)中,所得盐酸的密度为1.09g/mL,则此盐酸的物质的量浓度为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋约占地球表面积的71%,对其进行开发利用的部分流程如图所示。下列说法不正确的是( )

A. 可用BaCl2溶液除去粗盐中的SO42-
B. 从苦卤中提取Br2的反应的离子方程式为:2Br-+Cl2===2Cl-+Br2
C. 试剂1可以选用石灰乳
D. 工业上,电解熔融Mg(OH)2冶炼金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气在工农业生产中有重要应用。
(1)写出工业合成氨的化学方程式_____。
(2)某化学实验小组同学利用以下装置制备氨,并探究氨的性质(部分仪器已略去)。
请回答:

①实验室制备氨的化学方程式为_____。
②用装置B收集氨时,氨的进气口是____(选填“a”或“b”)。打开装置B中的活塞c,若观察到烧瓶内产生了红色喷泉,则说明氨具有的性质是______,____。
③向C中NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象。浓盐酸液滴附近会出现白烟,发生反应的化学方程式为_____。FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括Fe2++2NH3·H2O===Fe(OH)2↓+2NH4+和_____。
④为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨的是____(填序号)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com