
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题。
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为_______(写离子符号);若所得溶液c(HCO3-):c(CO32-)=2:1,溶液pH=______。(室温下,H2CO3的K1=4×10-7;K2=5×10-11)
(2)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g) ![]() (2CO(g)+2H2(g)
(2CO(g)+2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol-1 | 413 | 745 | 436 | 1075 |
则该反应的△H=___________。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是____________(填“A”或“B”)
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如下图所示。此反应优选温度为900℃的原因是_______________。
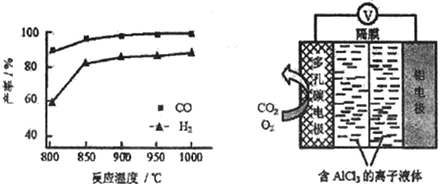
(3)O2辅助的A1-CO2电池工作原理如上图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的正极反应式:6O2+6e-=6O2- 6CO2+6O2-=3C2O42-+6O2
反应过程中O2的作用是_______________。该电池的总反应式:_________________。
【答案】 CO32- 10 +120 kJ·mol-1 B 900 ℃时,合成气产率已经较高,再升高温度产率增幅不大,但能耗升高,经济效益降低。 催化剂 2Al+6CO2=Al(C2O4)3
【解析】(1)根据K2=![]() =5×10-11,结合溶液的pH=13分析判断;再结合溶液c(HCO3-):c(CO32-)=2:1,计算溶液pH;
=5×10-11,结合溶液的pH=13分析判断;再结合溶液c(HCO3-):c(CO32-)=2:1,计算溶液pH;
(2)①根据△H=反应物总键能-生成物总键能计算;该反应的正反应是气体物质的量增大的反应,结合增大压强平衡逆向移动分析判断;②根据图像900℃时合成气产率已经较高,分析解答;
(3)该原电池中Al作负极,失电子生成铝离子,根据正负极电极反应式相加即得电池反应式解答。
(1)K2=![]() =5×10-11,则c(H+)=
=5×10-11,则c(H+)=![]() ,当c(HCO3-)=c(CO32-),c(H+)=5×10-11,pH在10.3,如果溶液的pH=13,则c(HCO3-)<<c(CO32-),所以该溶液中所得阴离子为c(CO32-);K2=
,当c(HCO3-)=c(CO32-),c(H+)=5×10-11,pH在10.3,如果溶液的pH=13,则c(HCO3-)<<c(CO32-),所以该溶液中所得阴离子为c(CO32-);K2=![]() =5×10-11,且所得溶液c(HCO3-):c(CO32-)=2:1,c(H+)=
=5×10-11,且所得溶液c(HCO3-):c(CO32-)=2:1,c(H+)=![]() =5×10-11×2=1×10-10,pH=10,故答案为:c(CO32-);10;
=5×10-11×2=1×10-10,pH=10,故答案为:c(CO32-);10;
(2)①该反应的△H=反应物总键能-生成物总键能=[4×413+2×745-2×1075-2×436]kJ/mol =+120kJ/mol;该反应的正反应是气体物质的量增大的反应,增大压强平衡逆向移动,A在反应过程中压强在不断增大、B在反应过程中压强不变,所以A相当于B来说是增大压强,平衡逆向移动,所以A中反应物转化率小于B,则两容器中反应达平衡后吸收的热量较多的是B,故答案为:+120kJ/mol;B;
②根据图知,900℃时合成气产率已经较高,再升高温度产率增幅不大,且升高温度耗能较大,经济效益降低,温度低时合成气产率降低且反应速率降低,故答案为:900 ℃时,合成气产率已经较高,再升高温度产率增幅不大,但能耗升高,经济效益降低;
(3)该原电池中Al作负极,失电子生成铝离子,电极反应式为Al-3e-=Al 3+;在正极的反应式中,在第一个反应中作反应物、在第二个反应中作生成物,所以氧气在反应中作催化剂;在得失电子相同条件下,正负极电极反应式相加即得电池反应式,电池反应式为2Al+6CO2=Al2(C2O4)3,故答案为:催化剂;2Al+6CO2=Al2(C2O4)3。


科目:高中化学 来源: 题型:
【题目】近年来,蜂胶已成为保健品的宠儿,其主要成分CAPE(咖啡酸苯乙酯)因具有极强的抗炎和抗氧化活性得以在食品、医学以及其他领域广泛应用。通过下列途径可合成咖啡酸苯乙酯。
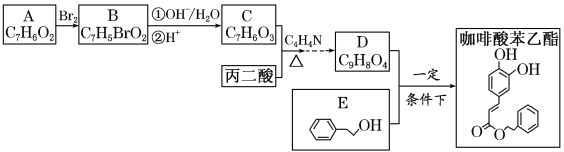
已知:A的核磁共振氢谱(1HNMR)显示,分子中有4种不同化学环境的氢原子,A能与FeCl3溶液发生显色反应。
(1)丙二酸的结构简式为________________。
(2)咖啡酸苯乙酯含有的含氧官能团名称为_________________________。
(3)咖啡酸苯乙酯的分子式为________________,D的结构简式为____________________。
(4)反应类型:B―→C______________。
(5)A―→B的化学方程式为_______________________________________________________。
(6)写出同时满足下列条件的C的所有同分异构体的结构简式(不考虑立体异构):________________。
a.属于酯类
b.能发生银镜反应
c.与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如下图
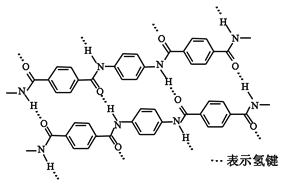
下列关于该高分子的说法正确的是
A. 完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境
B. 完全水解产物的单个分子中,含有官能团―COOH或―NH2
C. 氢键对该高分子的性能没有影响
D. 结构简式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由铁、锌、镁、铝四种金属中的两种组成的10g混合物与足量的盐酸反应,反应后生成的氢气在标准状况下体积为11.2L.则混合物中一定含有的金属是( )
A.锌B.铁C.镁D.铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
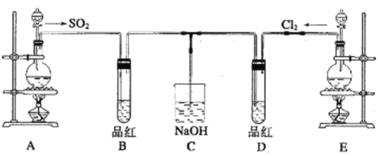
(1)实验室用装置A制备SO2,某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,可能的原因是_____________(合理均可);C装置的作用___________________。
(2)反应开始一段时间后,观察到B、D两个试管中的品红溶液都褪色,停止通气后,再给B、D两个试管分别加热;两个试管中的现象分别为:B:_______________,D:________________。
(3)若将B中品红换成H2S溶液,通SO2一段时间后B中现象为_____,该反应的化学方程式为______,其中氧化产物与还原产物的物质的量之比为________。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是地球大气中一种微量气体,人类正在保护和利用臭氧。
(1)氮氧化物会破坏臭氧层,已知:
①NO(g) + O3(g)![]() NO2(g) + O2 (g) ΔH1 = 200.9 kJ·mol1
NO2(g) + O2 (g) ΔH1 = 200.9 kJ·mol1
②2NO(g) +O2 (g)![]() 2NO2 (g) ΔH 2 = 116.2 kJ·mol1
2NO2 (g) ΔH 2 = 116.2 kJ·mol1
则反应:2O3(g)![]() 3O2 (g) ΔH=______。
3O2 (g) ΔH=______。
(2)实验室将氧气和臭氧的混合气体0.896 L(标准状况)通入盛有20.0 g铜粉的反应器中,加热充分反应后,粉末的质量变为21.6 g。则原混合气中臭氧的体积分数为______。
(3)大气中的部分碘源于O3对海水中I—的氧化。将O3持续通入NaI溶液中进行模拟研究,探究Fe2+对氧化I—反应的影响,反应体系如图1,测定两组实验中I3—浓度实验的数据如图2所示:
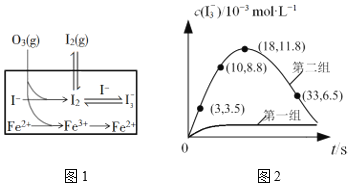
①反应后的溶液中存在化学平衡:I2(aq)+I(aq) ![]() I3-(aq),当c(I3-)/c(I-)=6.8时,溶液中c(I2)=______。(已知反应的平衡常数K=680)
I3-(aq),当c(I3-)/c(I-)=6.8时,溶液中c(I2)=______。(已知反应的平衡常数K=680)
②结合实验数据可知,Fe2+对I的转化率的影响是_____(填“增大”“无影响”或“减小”)。
③第二组实验18 s后,I3—浓度下降。导致I3—浓度下降的原因是_____。
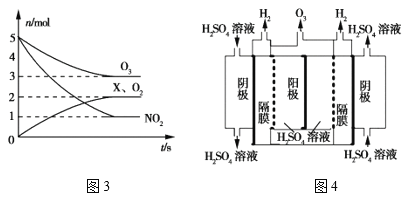
(4)臭氧是一种杀菌消毒剂,还是理想的烟气脱硝剂。
①一种脱硝反应中,各物质的物质的量随时间的变化如图3所示,X为___(填化学式)。
②一种臭氧发生装置原理如图4所示。阳极(惰性电极)的电极反应式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将 2 molSO2 和 1 molO2 充入一定容密闭容器中,在催化剂存在下进行下列反应: 2SO2(g)+O2(g)![]() 2SO3(g);△H=-197kJ/ mol,当达到平衡状态时,下列说法中正确的是
2SO3(g);△H=-197kJ/ mol,当达到平衡状态时,下列说法中正确的是
A. 生成 SO3为2 mol
B. 反应放出 197 kJ 的热量
C. SO2和SO3 物质的量之和一定为 2mol
D. SO2、O2、SO3的物质的量之比一定为2:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图与对应的反应情况符合的是

A. 向含0.01 mol KOH和0.01 mol Ca(OH)2的混合溶液中缓慢通入CO2至过量
B. 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量
C. 向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至过量
D. 向含有少量氢氧化钠的NaAlO2溶液中逐滴加入盐酸至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应A(g)+B(g)=C(g)+D(g),过程中的能量变化如图所示,下列说法中正确的是( )
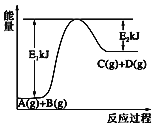
A. A的能量一定低于C
B. 反应物断键吸收的总能量大于产物新键形成放出的总能量
C. 化学反应中的能量变化都表现为热量的变化
D. 1mol气体A和1mol气体B反应生成1mol气体C和1molD
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com