
| A�����������ḻ��ú̿��Դ�����ٶ�ʯ�͵����� |
| B�����������غ������˽���������վ�������Դ���� |
| C��������ܶೡ�ݵ����ʹ�÷Ǿ��象Ĥ���Գ������̫���ܣ����ֵ�̼���� |
| D������ͣ������װ�������ʩ���ɽ�����β����CO��NOx��Ӧ���������� |


 �̲�ȫ���ִʾ�ƪϵ�д�
�̲�ȫ���ִʾ�ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
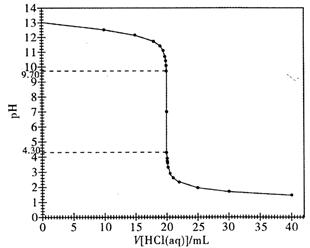
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.1mol/L��������Һ����ˮ�����c(H+)=10��13mo1?L��l |
| B��Na2CO3��Һ�м�������Ca(OH)2���壬CO32��ˮ��̶ȼ�С����Һ��pH��С |
| C��CuSO4��Һ���ɵõ�Cu(OH)2���� |
| D�������pH=3�Ĵ�����Һ��pH=11��NaOH��Һ����pH=7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��HSO4�� | B��Cl- | C��aX+ | D��bX2- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Y3+��W- | B��Z2-��X+ | C��X+��Y3+ | D��X+��Z2- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A����Һ��pH��a��b��c��d |
| B����Һ�ĵ���������a��b��d��c |
| C��a��b��Һ������ |
| D��c��d��Һ�ʼ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
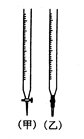
| ʵ���� | ����HCl��Һ�����(mL) | ����NaOH��Һ�����(mL) |
| 1 | 20.00 | 23.00 |
| 2 | 20.00 | 23.10 |
| 3 | 20.00 | 22.90 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0��5��10��7mol/L | B��1��10��7mol/L | C��2��10��7mol/L | D��4��10��7mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��2H2��g��+O2��g��=2H2O��g������H=+484kJ·mol-1 |
| B��2H2��g��+O2��g��=2H2O��l������H =��484kJ·mol-1 |
C��H2��g��+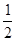 O2��g��=H2O��g������H =+242kJ·mol-1 O2��g��=H2O��g������H =+242kJ·mol-1 |
D��H2O��g��=H2��g��+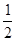 O2��g������H =+242kJ·mol-1 O2��g������H =+242kJ·mol-1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com