
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
分析 (1)①根据升高温度平衡吸热方向移动以及平衡逆向移动平衡常数减小;
②直接标志:①速率关系:正反应速率与逆反应速率相等,②反应体系中各物质的百分含量保持不变.
间接标志:①混合气体的总压强、总体积、总物质的量不随时间的改变而改变(m+n≠p+q);②各物质的浓度、物质的量不随时间的改变而改变;③各气体的体积、各气体的分压不随时间的改变而改变;
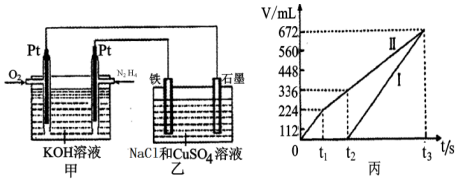
(2)电池通入肼N2H4的为负极,乙中石墨电极为阳极、铁电极为阴极,开始Cl-在阳极放电生成氯气,阴极Cu2+放电生成Cu,故图丙中Ⅰ表示阴极产生的气体,Ⅱ表示阳极产生的气体,t1前电极反应式为:阳极2Cl--4e-=Cl2↑,依据生成的迁移体积计算物质的量得到氯化钠物质的量计算浓度,阴极2Cu2++4e-=2Cu,t1~t2电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极2Cu2++4e-=2Cu,t2点后电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极4H++4e-=2H2↑,所以t1~t2 阳极上生成氧气,根据氧气的量计算氢氧根离子的物质的量,水电离出等物质的量的氢离子和氢氧根离子,根据公式计算得出C(H+),从而得出溶液的pH.
解答 解:(1)①N2(g)+3H2(g)?2NH3(g)△H<0为放热反应,升高温度,平衡逆向移动,平衡常数减小,所以K2<K1,
故答案为:<;
③a.平衡时反应混合物中各组分的含量保持不变,但容器内N2、H2、NH3的浓度之比不一定为为1:3:2,所以不能作为平衡的标志,故a错误;
b.平衡时不同物质表示速率之比等于系数之比说明到达平衡,即3v(N2)正=v(H2)逆说明反应达到平衡,故b错误;
c.反应前后气体体积减小,若压强不变,说明反应达到平衡,故c正确;
d.反应前后气体的质量不变,容器的体积不变,所以密度不变,所以混合气体的密度保持不变不能作为平衡的标志,故d错误;
故答案为:c;
(2)①肼燃料电池中,在碱性条件下,N2H4失电子生成氮气与水,电极反应式为:N2H4+4OH--4e-=N2↑+4H2O,
故答案为:N2H4+4OH--4e-=N2↑+4H2O;
②乙中石墨电极为阳极、铁电极为阴极,开始Cl-在阳极放电生成氯气,阴极Cu2+放电生成Cu,故图丙中Ⅰ表示阴极产生的气体,Ⅱ表示阳极产生的气体,t1前电极反应式为:阳极2Cl--4e-=Cl2↑,生成氯气为224mL,由2Cl--2e-=Cl2↑可知,n(NaCl)=2n(Cl2)=$\frac{0.224L}{22.4L/mol}$×2=0.02mol,所以c(NaCl)=$\frac{0.02mol}{0.1L}$=0.2mol/L;
故答案为:0.2mol/L;
③t2点后电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极4H++4e-=2H2↑,所以t1~t2 阳极上生成氧气,t1~t2Ⅱ产生的气体体积=0.336L-0.224L=0.112L,阳极上生成112mL氧气需要n(OH-)=$\frac{0.112L×4}{22.4L/mol}$=0.02mol,水电离出等物质的量的氢离子和氢氧根离子,所以n(H+)=0.02mol,c(H+)=$\frac{0.02mol}{0.1L}$=0.2mol/L,所以溶液的pH=1-lg2=0.7,
故答案为:0.7.
点评 本题考查较为综合,涉及化学平衡的有关计算、电解池原理等知识点,题目难度中等,注意电解硫酸铜和氯化钠混合溶液时,明确离子的放电顺序是解本题的关键,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2F2+2H2O=4HF+O2反应中,水作还原剂,失电子 | |
| B. | 2Na+2H2O=2NaOH+H2↑反应中,水被氧化 | |
| C. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$ CO2+2H2O反应中,H2O是还原产物 | |
| D. | Na2O+H2O=2Na++2OH-反应中,水既不是氧化剂也不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO4-、SO42-、I-、Na+ | B. | Na+、Cu2+、S2-、NO3- | ||
| C. | K+、Al3+、HCO3-、SO42- | D. | Na+、K+、Cl-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔既是物质的数量单位又是物质的质量单位 | |
| B. | 阿伏加德罗常数是 12kg12C中含有的碳原子数 | |
| C. | 1molH2O中含有2mol H和1mol O | |
| D. | 一个NO分子的质量是ag,一个NO2分子的质量是bg,则氧原子的摩尔质量是(b-a)g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | K+、Cu2+、OH-、SO42- | B. | K+、Na+、Cl-、NO3- | ||
| C. | Zn2+、NH4+、NO3+、Cl- | D. | K+、Na+、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
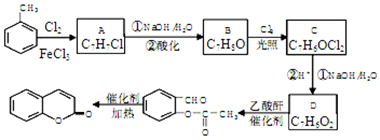
 ,A→B的反应类型是取代反应.
,A→B的反应类型是取代反应.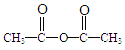 )反应,除生成
)反应,除生成 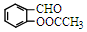 外,同时生成的另一种产物的结构简式是CH3COOH.
外,同时生成的另一种产物的结构简式是CH3COOH.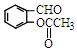 互为同分异构体,且具有以下特点:
互为同分异构体,且具有以下特点:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在KClO3+6HCl=3Cl2↑+KCl+3H2O中,被氧化的氯原子和被还原的氯原子的个数比为6:1 | |
| B. | 在反应:2KNO3+3C+S=K2S+N2↑+3CO2↑,则被还原的元素为氮和硫 | |
| C. | 失电子能力难的原子获得电子的能力一定强 | |
| D. | 在化学反应中某元素由化合态变为游离态,该元素一定被还原了 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com