
【题目】太阳能电池在日常生活中已广泛应用,一种替代硅光电池的全天候太阳能电池已投入商用,其工作原理如图。下列说法不正确的是()
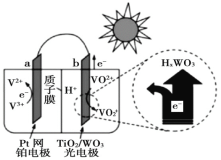
A.硅太阳能电池工作原理与该电池不相同
B.夜间时,该电池相当于蓄电池放电,a 极发生氧化反应
C.光照时,b 极的电极反应式为VO2+﹣e﹣+H2O=VO![]() +2H+
+2H+
D.光照时,每转移 1mol 电子,有 2 mol H+ 由 b 极区经质子交换膜向 a 极区迁移
【答案】D
【解析】
全天候太阳能电池有光照时对电池充电,相当于电解池,阳极发生氧化反应,失去电子,因此b为阳极,电极反应式为:VO2++H2O-e-=VO![]() +2H+;a为阴极,电极反应式为:V3++e-=V2+;夜间无光照时,相当于蓄电池放电,为原电池,结合原电池和电解池原理分析解答。
+2H+;a为阴极,电极反应式为:V3++e-=V2+;夜间无光照时,相当于蓄电池放电,为原电池,结合原电池和电解池原理分析解答。
A.硅太阳能电池是用半导体原理将光能转化为电能,是物理变化,而该电池是化学能转化为电能,两者原理不同,故A正确;
B.夜间无光照时,相当于蓄电池放电,为原电池,a极为负极,发生氧化反应,电极反应式为:V2+-e-=V3+,故B正确;
C.光照时,对电池充电,b极是阳极,发生氧化反应,电极反应式为VO2++H2O-e-=VO![]() +2H+,故C正确;
+2H+,故C正确;
D.光照时,为电解池,电解池中氢离子向阴极移动,所以氢离子由b极室通过质子膜进入a极室,每转移1mol电子,有1mol氢离子由b极区经质子膜向a极区迁移,故D错误;
故选D。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】有机一无机活性材料的液流电池具有能量密度大、环境友好等特点。其负极反应为Zn-2e-+4NH3·H2O=Zn(NH3)42++4H2O,以LiPF6为电解质,工作示意图如图。电池放电过程中,下列说法错误的是
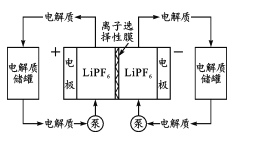
A.电子从负极经外电路流向正极
B.已知正极发生反应: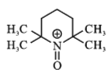 +e-→
+e-→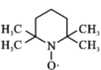 ,此过程为还原反应
,此过程为还原反应
C.负极附近溶液pH会降低
D.电解质溶液中的Li+自左向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸正丁酯(CH3CH2CH2CH2OOCCH3)是一种优良的有机溶剂。实验室制备少量乙酸正丁酯的反应为CH3COOH+CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OOCCH3+H2O。
CH3CH2CH2CH2OOCCH3+H2O。
实验步骤如下:
步骤1:向仪器A中加入11.5 mL正丁醇(微溶于水)、1 mL浓H2SO4、7.2 mL冰醋酸及沸石少许。
步骤2:按如图连接装置。
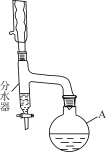
步骤3:向分水器中预先加少量水(略低于支管口)。通入冷却水,加热回流。
步骤4:将分水器分出的酯层和反应液合并转入分液漏斗中,依次用5% Na2CO3溶液、水洗涤,分离出有机相。
步骤5:将有机相用无水硫酸镁干燥、过滤、蒸馏,收集乙酸正丁酯。
(1)仪器A的名称是________;向其中加入碎瓷片的目的是________。
(2)装置中分水器的作用是________,判断反应已经完成的标志是________。
(3)反应时生成的主要有机副产物有丁醚和________(用结构简式表示)。
(4)步骤4中,分离出有机相的具体操作是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的氯化钠溶液,但手边只有混有Na2SO4、NH3HCO3 等杂质 的NaCl。某学生设计了如下图方案提取纯净物的NaCl溶液(已知:NH4HCO3![]() NH3↑+H2O+CO2↑)
NH3↑+H2O+CO2↑)
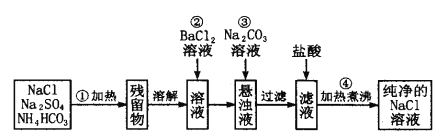
如果此方案正确,那么:
(1)操作①可选择_______ 或__________(仪器)。
(2)操作②为什么不用加硝酸钡溶液?其理由是___________。
(3)进行操作②后,如何判断SO42-已除尽的方法是__________ 。
(4)操作③的目的是________,写出此操作涉及的离子方程式:___________
(5)操作④的目的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡元素参与组成的新型材料有着广泛的用途,回答下列问题。
(1)基态铁原子核外共有________种不同空间运动状态的电子。铁、钴、镍基态原子中,核外未成对电子数最少的原子价层电子轨道表示式(电子排布图)为________。
(2)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和74pm,则熔点NiO________FeO(填“>”“<”或“=”),原因是________。
(3)Cr的一种配合物结构如图所示:
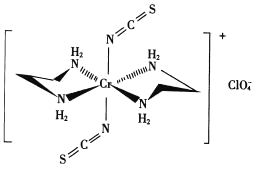
①阴离子![]() 的空间构型为________形。
的空间构型为________形。
②配离子中,中心离子的配位数为_______,N与中心原子形成的化学键称为_______键。
③配体H2NCH2CH2NH2(乙二胺)中碳原子的杂化方式是________,分子中三种元素电负性从大到小的顺序为________。
(4)一种新型材料的晶胞结构如图1所示,图2是晶胞中Sm和As原子的投影位置。
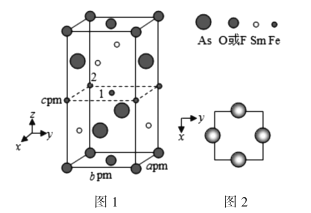
图1中F和O共同占据晶胞的上下底面位置,若两者的比例依次用x和1x代表,则该化合物的化学式表示为________,晶体密度ρ=________g·cm3(用含x的表达式表示,设阿伏加德罗常数的值为NA)。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标(![]() ),则原子2的坐标为________。
),则原子2的坐标为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组设计如下实验装置制备SnCl4。
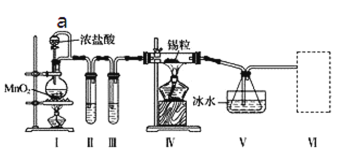
已知:a.金属锡熔点231 ℃,化学活泼性与铁相似;
b.干燥的氯气与熔融金属锡反应生成SnCl4,SnCl4的沸点114 ℃;
c.SnCl2、SnCl4均易与水蒸气反应,且Sn2+易被氧化。根据图甲装置回答:
(1)导管a的作用是____________________________________,实验时应先点燃______(填“I”或“IV”)处酒精灯。
(2)Ⅰ处装置中反应的离子方程式是________,试管Ⅱ中的试剂是____________________,Ⅲ中的试剂是____。
(3)装置V的作用是_________________,Ⅵ处装置最好选用________(填字母),其作用是________。
(4)实验结束后,欲回收利用装置Ⅰ中未反应完的MnO2,需要的玻璃仪器有______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是
A.2Na2O2+2H2O =4NaOH+O2↑B.Cl2+ H2O![]() HClO + HCl
HClO + HCl
C.2F2+2H2O=4HF+O2D.4Fe(OH)2+O2+2H2O=4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向0.10mol/L的HCOONH4溶液中通入HCl或加入NaOH固体调节溶液pH(忽略溶液体积变化),部分粒子的浓度随pH的变化关系如图所示。其中[NH3]表示溶液中NH3与NH3·H2O的浓度之和,M点的坐标为(6.5,-4)。下列说法不正确的是
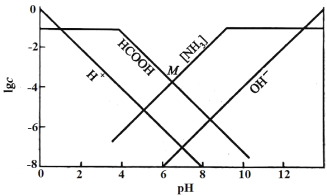
A.此温度下,Kw=1.0×10-14
B.pH<12时,溶液中[NH3]>c(OH-)
C.M点有c(HCOO-)>c(HCOOH)>c(NH4+)>c(H+)>c(OH-)
D.Ka(HCOOH)的数量级为10-4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com