
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 五种元素的原子序数依次递增。已知:①
五种元素的原子序数依次递增。已知:①![]() 位于周期表中第四周期
位于周期表中第四周期![]() 族,其余的均为短周期主族元素:②
族,其余的均为短周期主族元素:②![]() 的氧化物是光导纤维的主要成分;③
的氧化物是光导纤维的主要成分;③![]() 原子核外
原子核外![]() 层电子数为奇数;④
层电子数为奇数;④![]() 是形成化合物种类最多的元素;⑤
是形成化合物种类最多的元素;⑤![]() 原子
原子![]() 轨道的电子数为4。请回答下列问题:
轨道的电子数为4。请回答下列问题:
(1)写出一种![]() 元素形成氢化物的化学式_____________。
元素形成氢化物的化学式_____________。
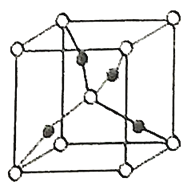
(2)在1个由![]() 与
与![]() 形成的
形成的![]() 晶胞中(结构如图所示)所包含的
晶胞中(结构如图所示)所包含的![]() 原子数目为____________个。
原子数目为____________个。
(3)在[F(NH3)4]2+离子中,![]() 的空轨道接受
的空轨道接受![]() 的氮原子提供的__________形成配位键。
的氮原子提供的__________形成配位键。
(4)常温下![]() 、
、![]() 和氢元素按原子数目1:1:2形成的气态常见物质
和氢元素按原子数目1:1:2形成的气态常见物质![]() 是__________(写名称),
是__________(写名称),![]() 物质分子中
物质分子中![]() 原子轨道的杂化类型为__________,
原子轨道的杂化类型为__________,![]() 分子中
分子中![]() 键的数目为__________
键的数目为__________![]() 。
。
(5)![]() 、
、![]() 、
、![]() 三种元素的第一电离能数值由小到大的顺序为__________(写元素符号)。
三种元素的第一电离能数值由小到大的顺序为__________(写元素符号)。
【答案】CH4 4 孤电子对 甲醛 sp2杂化 3 Si<C<N
【解析】
![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 五种元素的原子序数依次递增。根据①F位于周期表中第四周期
五种元素的原子序数依次递增。根据①F位于周期表中第四周期![]() 族可判断其为Cu;根据②E的氧化物是光导纤维的主要成分可判断E为Si;根据④X是形成化合物种类最多的元素可判断X为C;根据③Y原子核外L层电子数为奇数且原子序数比X的大可判断其属于第二周期的元素,可能为N或F;根据⑤Z的原子P轨道的电子数为4推测出Z可能为O或S,但E的原子序数大于Z,E为Si,所以Z只能为O,处于C和O之间的Y只能为N,所以
族可判断其为Cu;根据②E的氧化物是光导纤维的主要成分可判断E为Si;根据④X是形成化合物种类最多的元素可判断X为C;根据③Y原子核外L层电子数为奇数且原子序数比X的大可判断其属于第二周期的元素,可能为N或F;根据⑤Z的原子P轨道的电子数为4推测出Z可能为O或S,但E的原子序数大于Z,E为Si,所以Z只能为O,处于C和O之间的Y只能为N,所以![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 分别为C、N、O、Si、Cu,据此解题。
分别为C、N、O、Si、Cu,据此解题。
(1)X为C,![]() 元素形成的氢化物有很多,有烷烃、烯烃、炔烃等,其中的一种的化学式为CH4;
元素形成的氢化物有很多,有烷烃、烯烃、炔烃等,其中的一种的化学式为CH4;
(2)![]() 为Cu2O,根据化学式中原子个数比Cu:O=2:1,然后算出图中该晶胞的黑球个数为:1×4=4,白球个数为:8×1/8+1=2,所以黑球代表的是Cu原子,白球代表的是O原子,所以该晶胞中所包含的Cu原子数目为4个;
为Cu2O,根据化学式中原子个数比Cu:O=2:1,然后算出图中该晶胞的黑球个数为:1×4=4,白球个数为:8×1/8+1=2,所以黑球代表的是Cu原子,白球代表的是O原子,所以该晶胞中所包含的Cu原子数目为4个;
(3)在[Cu(NH3)4]2+离子中,![]() 的空轨道接受
的空轨道接受![]() 的氮原子提供的孤电子对形成配位键;
的氮原子提供的孤电子对形成配位键;
(4)常温下C、O和氢元素按原子数目1:1:2形成的气态常见物质![]() 是甲醛,甲醛分子中C原子可以形成四个化学键,因为碳的价电子数是4,其中,有两个单电子一起与氧的两个电子形成C=O,C剩余的两个单电子各与两个H形成两个C-H键,双键中含有一条σ键和一条π键,两条C-H单键都是σ键,所以σ键数=2+1=3,杂化轨道数=σ键数+孤对电子数(C无孤对电子,所以孤对电子数为0),所以杂化轨道数=3,为sp2杂化,1mol HCHO分子中σ键的数目为3
是甲醛,甲醛分子中C原子可以形成四个化学键,因为碳的价电子数是4,其中,有两个单电子一起与氧的两个电子形成C=O,C剩余的两个单电子各与两个H形成两个C-H键,双键中含有一条σ键和一条π键,两条C-H单键都是σ键,所以σ键数=2+1=3,杂化轨道数=σ键数+孤对电子数(C无孤对电子,所以孤对电子数为0),所以杂化轨道数=3,为sp2杂化,1mol HCHO分子中σ键的数目为3![]() ;
;
(5)![]() 、
、![]() 、
、![]() 三种元素分别为C、N、Si,根据每周期第一种元素电离能最小,最后一种元素的电离能最大,呈逐渐增大的趋势;同族元素从上到下第一电离能变小来进行判断,C、N、Si的第一电离能数值由小到大的顺序为:Si<C<N。
三种元素分别为C、N、Si,根据每周期第一种元素电离能最小,最后一种元素的电离能最大,呈逐渐增大的趋势;同族元素从上到下第一电离能变小来进行判断,C、N、Si的第一电离能数值由小到大的顺序为:Si<C<N。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】加热10.0g碳酸钠和碳酸氢钠的混合物至质量不再变化,剩余固体的质量为8.45g,求混合物中碳酸钠的质量分数。( )
A. 58% B. 42% C. 36% D. 64%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年4月23日,中国人民军成立70周年。提到海军就不得不提航空母舰,我国正在建造第三艘航空母舰。航母的龙骨要耐冲击,甲板要耐高温,外壳要耐腐蚀.
(1)镍铬钢抗腐蚀性能强,基态C r 原子价层电子的电子排布式为_______________。
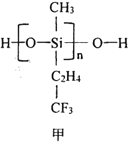
(2)航母甲板涂有一层耐高温的材料聚硅氧烷(结构如图申所示)。基态Si原子电子占据最高能级的电子云轮廓图为_______形:H、C、O、Si 四种元素中的电负性最高的是______。
(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①钛卤化物的熔点如下表所示:
TiF4 | TiCl4 | TiBr4 | TiI4 | |
熔点/℃ | 377 | -24 | 38 | 150 |
解释表中卤化物之间熔点差异的原因是________________________。
②OF2的空间构型为___________,其中O原子杂化方式为__________杂化。
③氯元素可以形成多种含氧酸,其酸性由弱到强的顺序为:HClO <HClO2<HClO3<HClO4。试解释其酸性强弱的原因是_______________ 。
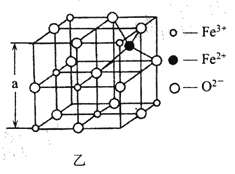
(4)海底金属软泥是在海洋底覆盖着的一层红棕色沉积物,蕴藏大着极的资源,含有硅、氧、锰、锌等。如图是从铁氧体离子晶体Fe3O4 中取出的能体现其晶体结构的一个立方体。
①晶体中的氧离子是否构成了面心立方最密堆积?________(填“是”或“否”);
②已知:Fe3O4 晶体的密度为5. 18gcm -3, 根据该图计算a________nrn (写出计算式即可,阿伏加德罗常数的值为N A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是某化学兴趣小组根据教材知识设计的证明Na2CO3与NaHCO3热稳定性的套管实验。下列叙述中不正确的是( )
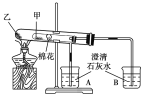
A. 甲为NaHCO3,乙为Na2CO3
B. 要证明NaHCO3受热能产生水,可在小试管内放置沾有少量无水硫酸铜粉末的棉花球
C. 加热不久就能看到A烧杯中的澄清石灰水变浑浊
D. 整个实验过程中A烧杯中的澄清石灰水不会变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 在元素周期表2、3、4周期中,元素
在元素周期表2、3、4周期中,元素![]() 、
、![]() 、
、![]() 、
、![]() 与元素
与元素![]() 相邻,已知:
相邻,已知:![]() 元素为磷元素;
元素为磷元素;![]() 的氯化物分子呈正四面体结构:
的氯化物分子呈正四面体结构:![]() 与
与![]() 可以形成一种高温结构陶瓷;
可以形成一种高温结构陶瓷;![]() 的最高化合价氧化物的水化物是强酸。下列选项错误的是( )
的最高化合价氧化物的水化物是强酸。下列选项错误的是( )
A.![]() 的氧化物的晶体类型是共价晶体
的氧化物的晶体类型是共价晶体
B.![]() 的单质在空气中广泛存在
的单质在空气中广泛存在
C.![]() 和
和![]() 形成的化合物中,
形成的化合物中,![]() 可以呈现的最高化合价是
可以呈现的最高化合价是![]() 价
价
D.![]() 、
、![]() 、
、![]() 的氢化物中,沸点最低的是
的氢化物中,沸点最低的是![]() 的氢化物
的氢化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示实验室某浓盐酸试剂瓶上的标签,试根据标签上的有关数据回答下列问题

(1)该浓盐酸的物质的量浓度为______mol·L-1。
(2)取用任意体积的该浓盐酸时,下列物理量中不随所取体积的多少而变化的是_______(填字母代号)。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制480 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取_________mL(保留一位小数)上述浓盐酸进行配制。如果实验室有5mL、10mL、50mL量筒,应选用___________mL量筒最好。
②配制时所需仪器除了量筒、烧杯、玻璃棒外,还需要的仪器有:___________。
③下列情况会导致所配溶液的浓度偏低的是__________(填字母代号)。
A.浓盐酸挥发,浓度不足
B.配制前容量瓶中有少量的水
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种优良的消毒剂,浓度过高时易发生分解,为了运输和贮存便利常将其制成
是一种优良的消毒剂,浓度过高时易发生分解,为了运输和贮存便利常将其制成![]() 固体,模拟工业上用过氧化氢法制备
固体,模拟工业上用过氧化氢法制备![]() 固体的实验装置如图所示。
固体的实验装置如图所示。
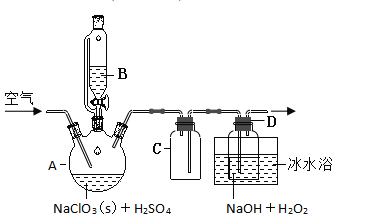
已知:![]() 熔点-59℃、沸点11℃、
熔点-59℃、沸点11℃、![]() 沸点150℃
沸点150℃
![]() 中的化学方程式:
中的化学方程式:![]()
(1)![]() 放入仪器
放入仪器![]() 中,仪器
中,仪器![]() 中的药品是__________(写化学式)。如果仪器
中的药品是__________(写化学式)。如果仪器![]() 改成分液漏斗,实验过程中可能会出现的实验现象__________。
改成分液漏斗,实验过程中可能会出现的实验现象__________。
(2)![]() 装置有明显缺陷,请绘出合理的装置图(标明气流方向)__________。
装置有明显缺陷,请绘出合理的装置图(标明气流方向)__________。
(3)向![]() 装置中通入空气,其作用是赶出
装置中通入空气,其作用是赶出![]() ,然后通过
,然后通过![]() 再到
再到![]() 中反应。通空气不能过快的原因是__________,通空气也不能过慢原因是__________。
中反应。通空气不能过快的原因是__________,通空气也不能过慢原因是__________。
(4)冰水浴冷却的目的是__________。
a.降低![]() 的溶解度 b.减少
的溶解度 b.减少![]() 的分解 c.使
的分解 c.使![]() 变为液态 d.加快反应速率
变为液态 d.加快反应速率
(5)写出![]() 中发生反应的化学方程式__________,
中发生反应的化学方程式__________,![]() 在反应起到__________作用。假设在反应中消耗掉
在反应起到__________作用。假设在反应中消耗掉![]() 则有__________
则有__________![]() 电子转移。
电子转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用98%的浓硫酸(密度为1.84g·cm-3)配制成浓度为0.5mol·L-1的稀硫酸480mL。
(1)选用的主要仪器有:量筒、玻璃棒、胶头滴管、烧杯、_______。
(2)请将下列各操作,按正确的序号填在横线上。
A.用量筒量取浓H2SO4 B.反复颠倒摇匀
C.用胶头滴管加蒸馏水至刻度线 D.洗净所用仪器
E.稀释浓H2SO4 F.将溶液转入容量瓶
其操作正确的顺序依次为_______。
(3)简要回答下列问题:
①所需浓硫酸的体积为_______mL。
②如果实验室有15mL、20mL、50mL的量筒应选用_____mL的量筒最好,量取时发现量筒不干净用水洗净后直接量取将使浓度____(“偏高”、“偏低”、“无影响”)。
③将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌的目的是_____,若搅拌过程中有液体溅出结果会使浓度偏______。
④在转入容量瓶前烧杯中液体应______,否则会使浓度偏_______;并洗涤烧杯和玻璃棒2~3次,洗涤液也要转入容量瓶,否则会使浓度_______。
⑤定容时必须使溶液凹液面与刻度线相切,若俯视会使浓度_____;仰视则使浓度______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】围绕下列几种物质:①铝、②Al2O3、③稀硝酸、④H2SO4、⑤Ba(OH)2固体、⑥稀氨水、⑦Al2(SO4)3、⑧NaOH溶液、⑨NaHCO3溶液,按要求回答下列问题:
(1)既能与强酸反应,又能与强碱反应的是_____________(填序号);
(2)属于电解质的是_____________(填序号);
(3)写出最适宜制取Al(OH)3的离子方程式_____________;
(4)两物质间发生反应的离子方程式为H++OH-=H2O,请写出该反应的化学方程式_____________;
(5)写出①和⑧反应的离子方程式________________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com