
| A. | 标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA | |
| B. | 标准状况下,2.24L NO和2.24L O2混合后气体分子数为0.15 NA | |
| C. | 加热条件下,1mol Fe投入足量的浓硫酸中,生成NA个SO2分子 | |
| D. | 0.1mol Na2O2与足是的潮湿的二氧化碳反应转移的电子数为0.1NA |
分析 A、氯气和水的反应为可逆反应;
B、标准状况下,2.24L NO即0.1molNO和2.24L O2即0.1mol氧气混合后生成0.1molNO2,并剩余0.05mol氧气;
C、加热条件下,铁投入足量的浓硫酸中反应变为+3价;
D、过氧化钠与二氧化碳的反应为歧化反应.
解答 解:A、氯气和水的反应为可逆反应,不能进行彻底,故转移的电子数小于0.1NA个,故A错误;
B、标准状况下,2.24L NO即0.1molNO和2.24L O2即0.1mol氧气混合后生成0.1molNO2,并剩余0.05mol氧气,而NO2中存在平衡:2NO2?N2O4,导致分子数减小,则最后分子数小于0.15NA个,故B错误;
C、加热条件下,铁投入足量的浓硫酸中反应变为+3价,故1mol铁失去3mol电子,根据得失电子数守恒可知,生成的二氧化硫分子个数为$\frac{3}{2}{N}_{A}$个,故C错误;
D、过氧化钠与二氧化碳的反应为歧化反应,故0.1mol过氧化钠转移0.1mol电子即0.1NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | Ⅱ中的现象 | 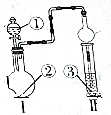 |
| A | 浓盐酸 | 碳酸钙 | 滴有酚酞的稀碳酸钠溶液 | 溶液由红色最终变为浅红色 | |
| B | 浓氨水 | 氧化钙 | 氯化铝溶液 | 先产生白色沉淀,后沉淀溶解 | |
| C | 冰醋酸 | 乙醇和浓硫酸 | 饱和碳酸钠溶液 | 溶液分层,上层为油状液体 | |
| D | 浓硝酸 | 铜 | 硅酸钠溶液 | 有胶状物生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
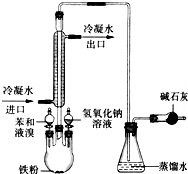 如图是实验室制取溴苯的装置图.
如图是实验室制取溴苯的装置图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1醋酸溶液与 0.1 mol•L-1醋酸溶液中c(H+)之比 | |
| B. | (NH4)2SO4溶液中c(NH4+)和c(SO42-)的物质的量浓度之比 | |
| C. | pH=2的盐酸和pH=12的Ba(OH)2溶液中溶质的物质的量浓度之比 | |
| D. | 0.2 mol/LCH3COONa溶液与 0.1 mol•L-1Na2CO3溶液中c(CH3COO-)与c(CO32-)之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体分子的数目和分子本身的大小 | |
| B. | 气体分子的质量和分子本身的大小 | |
| C. | 气体分子本身的大小和分子间的平均距离 | |
| D. | 气体分子的数目和分子间的平均距离 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | 6 | 7 | ||||||
| 3 | 1 | 3 | 5 | 8 | 10 | |||
| 4 | 2 | 4 | 9 |
 H++Cl-+HClO.
H++Cl-+HClO.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
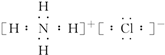 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
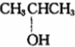 ⑨${\;}_{6}^{13}$C
⑨${\;}_{6}^{13}$C 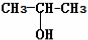 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有①④⑤ | C. | 只有②④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com