
【题目】一定温度下,在2L容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,由图中数据分析,反应物是____,t2时,N的浓度是_______________;若t2=1 min,从反应开始到t2 ,M的平均反应速率为_____________; 该反应的化学方程式为______;在反应达到化学平衡时,各组分的浓度保持______(填“相等”或“不变”)且_______(填“一定”或“不一定”相等,各物质的反应速率之比_______(填“一定”或“不一定”)等于化学计量数之比。

【答案】N 2 mol/L 1 mol/(L·min) 2NM 不变 不一定 一定
【解析】
依照图像M的物质的量逐渐增大,M为生成物,N的物质的量逐渐减小,N为反应物;在2L容器内,t2时N的物质的量为4mol,则N的浓度为c=![]() =
=![]() =2 mol/L;若t2=1 min,从反应开始到t2 ,M的平均反应速率为ν(M)=
=2 mol/L;若t2=1 min,从反应开始到t2 ,M的平均反应速率为ν(M)=![]() =
= 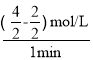 =1 mol/(L·min);M的初始物质的量为2mol,反应到t2时的物质的量为4mol,N的初始物质的量为8mol,反应到t2时的物质的量为4mol,变化的M的物质的量和变化的N的物质的量之比为=2:4=1:2,化学反应计量数之比等于物质的量的变化量之比,则化学反应方程式2NM;化学平衡标志主要有:根本标志是速率 v(正)= v(逆)。对相同物质:v(生成)= v(消耗)≠0; 反应物的浓度与生成物的浓度不在改变,所以在反应达到化学平衡时,各组分的浓度保持不变且不一定相等,各物质的反应速率之比一定等于化学计量数之比。
=1 mol/(L·min);M的初始物质的量为2mol,反应到t2时的物质的量为4mol,N的初始物质的量为8mol,反应到t2时的物质的量为4mol,变化的M的物质的量和变化的N的物质的量之比为=2:4=1:2,化学反应计量数之比等于物质的量的变化量之比,则化学反应方程式2NM;化学平衡标志主要有:根本标志是速率 v(正)= v(逆)。对相同物质:v(生成)= v(消耗)≠0; 反应物的浓度与生成物的浓度不在改变,所以在反应达到化学平衡时,各组分的浓度保持不变且不一定相等,各物质的反应速率之比一定等于化学计量数之比。
答案为:N;2 mol/L;1 mol/(L·min);2NM;不变;不一定;一定。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在某温度时,将n mol·L-1氨水滴入10 mL 1.0 mol·L-1 盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是

A. a点KW=1.0×10-14
B. b点:c(NH)>c(Cl-)>c(H+)>c(OH-)
C. 25 ℃时,NH4Cl水解常数为(n-1)×10-7(用n表示)
D. d点水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是我国化工专家侯德榜发明的联合制碱法简要流程:

关于此流程说法正确的是
A. 副产品Y是NH4HCO3B. 向母液中通入的气体X是CO2
C. 循环II是为了提高食盐的利用率D. 析出NaHCO3后的母液中只含NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们利用焦炭制取水煤气的上艺已广泛用于工业生产中。
I.以焦炭制各水煤气
已知:①C(s)+H2O (g)=CO(g)+H2(g) ![]() H= +130.0KJ/mol
H= +130.0KJ/mol
②CO2 (g)+H2(g)=CO(g)+H2O(g) ![]() H= +40.0KJ/mol
H= +40.0KJ/mol
(1) 在工业上,反应①是煤的综合利用的一种途径,其名称是______。 焦炭与水蒸气反应生成二氧化碳和氢气的热化学方程式为_____ 。
I I 焦炭废气的再利用
500°C时,在密闭容器中将焦炭废气中的CO2转化为二甲醚,其相关反应为:
主反应:2CO2 (g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
副反应:CO2 (g)+3H2(g)![]() CH3OH(g)+2H2O(g)
CH3OH(g)+2H2O(g)
(2)测得不同时间段部分物质的浓度如下表:

①1020 m in内,CH3OCH3的平均反应速率V(CH3OCH3)=__________。 ② 在上述特定条件下,己知主反应的速率方程为v=kca(CO2)×cb(H2)/cm(CH3OCH3) (k 为速率常数,a、 b、m均大于0 ) , 下列措施一定能提高主反应的反应速率的是______ (填字母序号)。
A . 适当温度 B .分离出二甲醚
C . 恒压减小c(CO2)/c(H2) D . 恒容下增大c(CO2)
②提高CH3OCH3产率的关键的因素是选用合适的催化剂,其原因是______ 。 若起始时CO2 和H2的浓度比为1:3,根据以上数据计算,上述主反应的平衡常数的计算表达式K= ______

(3)对该反应实验研究得出:在相同温度下,CO2的转化率等物理量随催化剂的组成比的变化关系如图所示。若温度不变,催化剂中n(Mn)/n(Cu)约是______ 时最有利于二甲瞇的合成,此时,若增大反应投料比n(H2)/n(CO2),平衡常数K将____ (填 “增大”、“减小”或 “不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有下列四种溶液:
① | ② | ③ | ④ |
0.1mol/L 盐酸 | pH = 3盐酸 | 0.1mol/L 氨水 | pH = 11氨水 |
下列说法正确的是
A. 由水电离出的c(H+):①>③
B. ③稀释到原来的100倍后,pH与④相同
C. ①与③混合,若溶液pH = 7,则V(盐酸)>V(氨水)
D. ②与④混合,若溶液显碱性,则所得溶液中离子浓度可能为:c(NH4+)>c(OH-)>c(Cl-)>c(H+)
【答案】D
【解析】试题分析:A.相同浓度的氨水与盐酸,氨水实际上还会促进水的电离,所以由水电离产生的c(H+):①>③,B.如果③是强碱的话,稀释100倍,其pH一定为11,但是关键氨水是弱碱,无论稀释到什么程度,都会有未电离的氨水存在,所以pH一定比11要小。C.①与③混合得到的是氯化铵,氯化铵是强酸弱碱盐,显酸性,所以若想要其pH为7,则氨水的用量一定要比盐酸的用量大才可以。D.所得溶液显碱性,所以氢氧根离子的浓度一定要比氢离子的浓度大,而且铵根离子的浓度要比氯离子的浓度大。
考点:考查了弱电解质的电离平衡、盐类水解、离子浓度的大小比较的相关知识。
【题型】单选题
【结束】
18
【题目】25℃时,常见的无机酸在水溶液中的电离子平衡常数如表,下列选项正确的是( )
氢氰酸(HCN) | 碳酸(H2C03) | 氢氟酸(HF) |
K=4.9×10﹣10 | K1=4.4×10﹣7 K2=4.7×10﹣11 | K=6.61×10﹣4 |
A. 氰化钠溶液中通入少量CO2:2CN﹣+H2O+CO2═2HCN+CO32﹣
B. NaCN与HCN的混合溶液中一定有:c(Na+)>c(CN﹣)>c(HCN)>c(H+)>c(OH-)
C. 25℃时CN-的水解平衡常数约为1.6×10-5
D. NaCN与HCN的混合溶液中:2c(Na+)=c(CN-)+c(HCN)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是




甲 乙 丙 丁
A. 图甲表示常温下稀释pH均为11的MOH溶液和NOH溶液时pH的变化,由图可知溶液的碱性:MOH>NOH
B. 图乙表示常温下0.100 0 mol·L-1醋酸溶液滴定20.00 mL0.100 0 mol·L-1 NaOH溶液的滴定曲线
C. 图丙表示反应CH4(g)+H2O (g)![]() CO(g)+3H 2(g)的能量变化,使用催化剂可改变Eb﹣Ea的值
CO(g)+3H 2(g)的能量变化,使用催化剂可改变Eb﹣Ea的值
D. 图丁表示反应2CO(g)+2NO(g)![]() N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率c>b>a
N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在0.1 mol·L-1的重铬酸钾(K2Cr2O7)溶液中存在如下平衡:
Cr2O72-+H2O![]() 2HCrO4
2HCrO4![]() 2CrO42-+2H+
2CrO42-+2H+
(1)重铬酸钾溶液呈______性,在强碱溶液中,铬元素的主要存在形式为________(填离子符号),向重铬酸钾溶液中加入适量稀硫酸,溶液中c(Cr2O72-)/c(CrO42-)将______(填“增大”、“减小”或“不变”)。
Ⅱ.已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:并按要求填写下列空白:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(1)若溶液中只溶解了一种溶质,则该溶质是 ________,上述四种离子浓度的大小顺序为________(选填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为________;
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)_______c(NH3·H2O) (填“大于”“小于”或“等于”)。
III.重金属离子对河流海洋造成严重污染。某化工厂废水(pH=2.0,d≈1 g·mL-1)中含有Ag+,Pb 2+等重金属离子,其浓度各约为0.0lmol·L-1。排放前拟用沉淀法除去这两种
离子,查找有关数据如下:
难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
(1)你认为往废水中投入________________(填字母序号),沉淀效果最好。
A. NaOH B.Na2S C.KI D. Ca(OH)2
(2)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120℃、101.3kPa,甲烷(CH4)和过量的O2的混合物,用电火花引燃(CH4+2O2=CO2+2H2O)后,恢复到原来的温度和压强,测得反应后气体密度为相同条件下H2密度的15倍,则原混合气体中甲烷和氧气的体积比为( )
A.2∶1B.1∶2C.1∶7D.1∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要意义,对于密闭容器中的反应:N2(g)+3H2(g)![]() 2NH3(g)+Q
2NH3(g)+Q
(1)写出该反应的逆反应的化学平衡常数表达式_____,升高温度,该反应化学反应速率_____,氢气的转化率____(以上均填“增大”、“减小”或“不变”)。实际生产中温度一般控制在500℃,原因是__________。
(2)能表示该反应在恒温恒容密闭容器中t1时刻后已经达到平衡状态的图示是________。

(3)浓度0.1mol/L的氨水,pH为11。当用蒸馏水稀释100倍时,则NH3·H2O的电离平衡将向______方向移动(填“正”或“逆”),溶液的pH将为____9(“大于”“小于”“等于”)。设计一个简单实验,证明一水合氨是弱碱:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com