
ДіСРңүРҰЧй¶ФТ»ФҒУР»ъИхЛбHAФЪИЬәБ±ҢғНЛ®µД»мғПМеПµЦРµДИЬҢвіМ¶ИҢшРРСРңүҰӘФЪ25ҰжК±Ә¬ИхЛбHAФЪЛ®ЦРІү·ЦµзАлӘ¬µ±HAЕЁ¶ИОҒ К±Ә¬ЖдµзАл¶ИОҒ0.20ӘЁµзАл¶ИӘҢТСµзАлµДHA·ЦЧУКэ/ЖрКәHAµДЧЬ·ЦЧУКэӘ©Ә»ФЪ±ҢЦРІү·Ц·ұЙъЛ«ңЫӘ¬ЙъіЙӘЁHAӘ©2ҰӘёГЖҢғвМеПµЦРӘ¬Т»ФҒУР»ъИхЛбHAФЪИЬәБ±ҢӘЁBӘ©ғНЛ®ӘЁWӘ©ЦРµД·ЦЕдПµКэОҒKӘ¬KӘҢCӘЁHAӘ©BӘҮCӘЁHAӘ©WӘҢ1.0Ә¬әөөпµҢЖҢғвғуӘ¬ТФ·ЦЧУРОКҢөжФЪµДHAФЪ±ҢғНЛ®БҢЦЦИЬәБЦРµД±ИАэОҒ1Әғ1Ә»ЖдЛыРЕПұИзПВӘғ
К±Ә¬ЖдµзАл¶ИОҒ0.20ӘЁµзАл¶ИӘҢТСµзАлµДHA·ЦЧУКэ/ЖрКәHAµДЧЬ·ЦЧУКэӘ©Ә»ФЪ±ҢЦРІү·Ц·ұЙъЛ«ңЫӘ¬ЙъіЙӘЁHAӘ©2ҰӘёГЖҢғвМеПµЦРӘ¬Т»ФҒУР»ъИхЛбHAФЪИЬәБ±ҢӘЁBӘ©ғНЛ®ӘЁWӘ©ЦРµД·ЦЕдПµКэОҒKӘ¬KӘҢCӘЁHAӘ©BӘҮCӘЁHAӘ©WӘҢ1.0Ә¬әөөпµҢЖҢғвғуӘ¬ТФ·ЦЧУРОКҢөжФЪµДHAФЪ±ҢғНЛ®БҢЦЦИЬәБЦРµД±ИАэОҒ1Әғ1Ә»ЖдЛыРЕПұИзПВӘғ
| 25ҰжЖҢғвМеПµ | ЖҢғвіӘКэ | мК±д | ЖрКәЧЬЕЁ¶И |
ФЪЛ®ЦРӘ¬HA 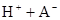 | 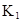 | 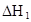 |  |
ФЪ±ҢЦРӘ¬2HA 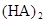 | 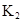 | 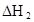 | 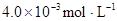 |
 ӘЁHAӘ©2Ә¬·өУ¦ФЪҢПµНОВ¶ИПВЧФ·ұҢшРРӘ¬Фт
ӘЁHAӘ©2Ә¬·өУ¦ФЪҢПµНОВ¶ИПВЧФ·ұҢшРРӘ¬Фт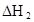 ___________0ҰӘ
___________0ҰӘ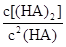 ӘҢ130Ә¬Фт·өУ¦Пт___________·ҢПтҢшРРҰӘ
ӘҢ130Ә¬Фт·өУ¦Пт___________·ҢПтҢшРРҰӘ ӘЁ1Ә©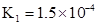 mol/L ӘЁ2Ә©3.2Ә¬ 40% ӘЁ3Ә©Әә ӘЁ4Ә©Хэ
mol/L ӘЁ2Ә©3.2Ә¬ 40% ӘЁ3Ә©Әә ӘЁ4Ә©Хэ
ҢвОцКФМв·ЦОцӘғӘЁ1Ә©HAФЪЛ®ИЬТғЦРµзАлӘғHA H++A-Ә¬ёщңЭµзАл¶ИОҒ0.20Ә¬cӘЁH+Ә©=3.0ҰБ10-3mol/LҰБ0.20=6.0ҰБ10-4mol?L?1Ә¬ФтK=6.0ҰБ10-4mol?L?1ҰБ6.0ҰБ10-4mol?L?1ҰВӘЁ3.0ҰБ10-3mol?L?1ҰҒ6.0ҰБ10-4mol?L?1Ә©=1.5ҰБ10-4mol?L?1ҰӘ
H++A-Ә¬ёщңЭµзАл¶ИОҒ0.20Ә¬cӘЁH+Ә©=3.0ҰБ10-3mol/LҰБ0.20=6.0ҰБ10-4mol?L?1Ә¬ФтK=6.0ҰБ10-4mol?L?1ҰБ6.0ҰБ10-4mol?L?1ҰВӘЁ3.0ҰБ10-3mol?L?1ҰҒ6.0ҰБ10-4mol?L?1Ә©=1.5ҰБ10-4mol?L?1ҰӘ
ӘЁ2Ә©pH=-lgӘЁH+Ә©=-lgӘЁ6.0ҰБ10-4Ә©=3.2Ә»өпµҢЖҢғвғуӘ¬ТФ·ЦЧУРОКҢөжФЪµДHAФЪ±ҢғНЛ®БҢЦЦИЬәБЦРµД±ИАэОҒ1Әғ1Ә¬cӘЁHAӘ©=3.0ҰБ10-3mol?L?1ҰҒ6.0ҰБ10-4mol?L?1=2.4ҰБ10-3mol?L?1Ә¬ЧҒ»ҮµДHAОҒ4.0ҰБ10-3mol?L?1ҰҒ2.4ҰБ10-3mol?L?1=1.6ҰБ10-3mol?L?1Ә¬ЛщТФФЪ±ҢМеПµЦРHAµДЧҒ»ҮВКОҒ,1.6ҰБ10-3mol?L?ҰВ4.0ҰБ10-3mol?L?1ҰБ100% ="40%" ҰӘ
ӘЁ3Ә©ёГ·өУ¦ФЪҢПµНОВ¶ИПВЧФ·ұҢшРРӘ¬TҢПРҰК±Ә¬?H-T?S<0Ә¬ТтОҒ·өУ¦ОпЦКµДБүәхРҰӘ¬әө?S<0Ә¬ЛщТФ?H<0
ӘЁ4Ә©УЙӘЁ2Ә©ЦРКэңЭүЙЛгіц2HA ӘЁHAӘ©2µДЖҢғвіӘКэK=8.0ҰБ10-4mol?L?1ҰВӘЁ2.4ҰБ10-3mol?L?1Ә©2=146Ә¬
ӘЁHAӘ©2µДЖҢғвіӘКэK=8.0ҰБ10-4mol?L?1ҰВӘЁ2.4ҰБ10-3mol?L?1Ә©2=146Ә¬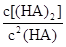 ӘҢ130<KӘ¬ЛщТФ·өУ¦ПтХэ·өУ¦·ҢПтҢшРРҰӘ
ӘҢ130<KӘ¬ЛщТФ·өУ¦ПтХэ·өУ¦·ҢПтҢшРРҰӘ
үәµгӘғ±ңМвүәІйЖҢғвіӘКэµДәЖЛгғНУ¦УГҰұpHғНЧҒ»ҮВКµДәЖЛгҰұ·өУ¦ЧФ·ұҢшРРµД·ЦОцҰӘ



| Дкә¶ | ёЯЦРүОіМ | Дкә¶ | іхЦРүОіМ |
| ёЯТ» | ёЯТ»Гв·СүОіМНЖәцӘҰ | іхТ» | іхТ»Гв·СүОіМНЖәцӘҰ |
| ёЯ¶ю | ёЯ¶юГв·СүОіМНЖәцӘҰ | іх¶ю | іх¶юГв·СүОіМНЖәцӘҰ |
| ёЯИэ | ёЯИэГв·СүОіМНЖәцӘҰ | іхИэ | іхИэГв·СүОіМНЖәцӘҰ |
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғМоүХМв
№¤ТµЙПЙъІъБтЛбµДБчіМНәИзПВӘғ 
Зл»ШөрПВБРОКМвӘғ
ӘЁ1Ә©ФзЖЪЙъІъБтЛбТФ»ЖМъүуОҒФБПӘ¬µ«ПЦФЪ№¤і§ЙъІъБтЛбТФБт»ЖОҒФБПӘ¬АнУЙКЗ ҰӘ
ӘЁ2Ә©ФЪЖшМеҢшИлөЯ»Ү·өУ¦КТЗ°Риң»»ҮµДФТтКЗ ҰӘ
ӘЁ3Ә©ФЪөЯ»Ү·өУ¦КТЦРНЁіӘК№УГіӘС№Ә¬ФЪөЛМхәюПВSO2µДЧҒ»ҮВКОҒ90%ҰӘµ«КЗІү·Ц·ұөп№ъәТІЙИҰёЯС№МхәюПВЦЖИҰSO3Ә¬ІЙИҰәУС№өлК©µДДүµДіэБЛәУүм·өУ¦ЛЩВКНвӘ¬»№үЙТФ Ә¬өУ¶шМбёЯЙъІъР§ВК ҰӘ
ӘЁ4Ә©№¤ТµЙъІъЦРіӘУГ°±ӘЛб·ЁҢшРРОІЖшНСБтӘ¬ТФөпµҢПыіэОЫИңӘ¬·ПОпАыУГµДДүµДҰӘУГ»ҮС§·ҢіМКҢ±нКңЖд·өУ¦ФАнӘғ ҰӘ
ӘЁ5Ә©іэБтЛṤҵНвӘ¬»№УРРн¶а№¤ТµЙъІъҰӘПВБРПа№ШµД№¤ТµЙъІъБчіМЦРХэИ·µДКЗ ҰӘ 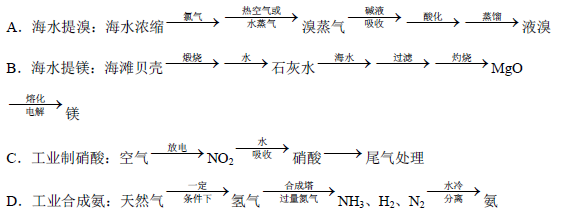
Ійүөөр°ёғНҢвОц>>
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғМоүХМв
ПтДіГЬ±ХИЭЖчЦРәУИл0.3mol AҰұ0.1mol CғНТ»¶ЁБүµДЖшМеBИэЦЦЖшМеӘ¬ФЪТ»¶ЁМхәюПВ·ұЙъ·өУ¦Ә¬ёчОпЦКЕЁ¶ИЛжК±әд±д»ҮИзПВГжЧуНәЛщКңҰӘПВГжУТНәОҒt2К±үМғуёД±дИЭЖчЦРМхәюӘ¬ЖҢғвМеПµЦРЛЩВКЛжК±әд±д»ҮµДЗйүцЗТt2ҰҒt5ЛДёцҢЧ¶О¶әёчёД±дТ»ЦЦМхәюӘ¬ЛщУГМхәюңщІ»Н¬ҰӘt3ҰҒt4ҢЧ¶ООҒК№УГөЯ»ҮәБҰӘ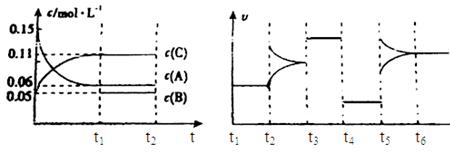
ӘЁ1Ә©Ифt1ӘҢ15sӘ¬Фтt0ҰҒt1ҢЧ¶ОТФCЕЁ¶И±д»Ү±нКңµД·өУ¦ЛЩВКОҒvӘЁCӘ©ӘҢ mol/(L?s)Ә»
ӘЁ2Ә©Ифt2ҰҒt3ҢЧ¶ОӘ¬CµДМе»э·ЦКэ±дРҰӘ¬өЛҢЧ¶ОvХэ vДж(МоҰ°өуУЪҰ±ҰұҰ°РҰУЪҰ±»тҰ°µИУЪҰ±)
ӘЁ3Ә©BµДЖрКәОпЦКµДБүОҒ molӘ»
ӘЁ4Ә©t1К±үМӘ¬ЖҢғвіӘКэKӘҢ Ә»
ӘЁ5Ә©t5ҰҒt6ҢЧ¶ОИЭЖчДЪAµДОпЦКµДБү№ІәхРҰ0.03molӘ¬¶шөЛ№эіМЦРИЭЖчУлНвҢзµДИИҢ»»»ЧЬБүОҒa KJӘ¬РөіцёГ·өУ¦µДИИ»ҮС§·ҢіМКҢ Ә»
ӘЁ6Ә©Ифt2К±үМғуНәПс±д»ҮИзПВНәӘ¬ФтёД±дМхәюОҒ 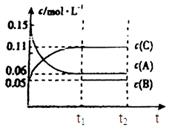
aӘ®ғгОВғгС№ПВӘ¬°өХХ2Әғ1±ИАэідИлИОТвБүµДBғНC
bӘ®ғгОВғгС№ПВӘ¬әУИл0.24mol AҰұ0.06mol BғН0.14mol C
cӘ®ғгОВғгС№ПВӘ¬әУИл0.12mol AҰұ0.1mol BғН0.22mol C
dӘ®ғгОВғгС№ПВӘ¬әУИл0.14mol BғН0.30mol C
Ійүөөр°ёғНҢвОц>>
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғМоүХМв
ФЪіӘОВҰұіӘС№Ұұ№вХХМхәюПВӘ¬N2ФЪөЯ»ҮәБ±нГжУлЛ®·ұЙъПВБР·өУ¦Әғ
2N2 (g)+6H2O(l) 4NH3 (g)+3O2 (g) ¦¤HӘҢ a kJҰ¤molӘ1
4NH3 (g)+3O2 (g) ¦¤HӘҢ a kJҰ¤molӘ1
ЙПКц·өУ¦NH3ЙъіЙБүУлОВ¶ИµД№ШПµӘ¬іӘС№ПВөпµҢЖҢғвК±ІвµГІү·ЦКµСйКэңЭИзПВ±нӘғ
| ОВ¶И T/K | 303 | 313 | 323 |
| NH3ЙъіЙБү/(10Ә6 mol) | 4.8 | 5.9 | 6.0 |
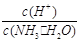 CӘ®c(H+)Ұ¤c(OHӘ) DӘ®
CӘ®c(H+)Ұ¤c(OHӘ) DӘ®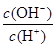
 4NO(g)+6H2O(g) ¦¤HӘә0Ә¬ИфЖрКәµДОпЦКµДБүПаН¬Ә¬ФтПВБР№ШПµНәХэИ·µДКЗ________(МоРтғЕ)Әғ
4NO(g)+6H2O(g) ¦¤HӘә0Ә¬ИфЖрКәµДОпЦКµДБүПаН¬Ә¬ФтПВБР№ШПµНәХэИ·µДКЗ________(МоРтғЕ)Әғ
| К±әд/ЕЁ¶И | c(NH3) (mol/L) | c(O2 ) (mol/L) | c(NO) (mol/L) |
| ЖрКә | 0.8000 | 1.600 | 0.000 |
| µЪ4 min | 0.3000 | 0.9750 | 0.5000 |
| µЪ6 min | 0.3000 | 0.9750 | 0.5000 |
| µЪ8 min | 0.7000 | 1.475 | 0.1000 |
Ійүөөр°ёғНҢвОц>>
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғМоүХМв
ДЬФөОКМвКЗИЛАаЙз»бГжБЩµДЦШөуүОМвӘ¬әЧөәКЗТ»ЦЦүЙФЩЙъДЬФөӘ¬ңЯУРүҒ·ұғНУ¦УГµД№гА«З°ң°Ә¬СРңүәЧөәңЯУРЦШТҒТвТеҰӘ
ӘЁ1Ә©УГCOғПіЙәЧөәµД·өУ¦ОҒӘғCO(g)+2H2(g)  CH3OH(g)ФЪИЭ»эОҒ1LҰӘµДГЬ±ХИЭЖчЦР·Ц±рідИл1molCOғН2molH2Ә¬КµСйІвµГәЧөәµДОпЦКµДБүғНОВ¶ИҰұК±әдµД№ШПµЗъПЯИзНәЛщКңҰӘФтёГХэ·өУ¦µДҰчH_______0ӘЁМоҰ°ӘәҰ±ҰұҰ°ӘңҰ±»тҰ°=Ұ±Ә©Ә¬ЕР¶ПµДАнУЙКЗ______ҰӘ
CH3OH(g)ФЪИЭ»эОҒ1LҰӘµДГЬ±ХИЭЖчЦР·Ц±рідИл1molCOғН2molH2Ә¬КµСйІвµГәЧөәµДОпЦКµДБүғНОВ¶ИҰұК±әдµД№ШПµЗъПЯИзНәЛщКңҰӘФтёГХэ·өУ¦µДҰчH_______0ӘЁМоҰ°ӘәҰ±ҰұҰ°ӘңҰ±»тҰ°=Ұ±Ә©Ә¬ЕР¶ПµДАнУЙКЗ______ҰӘ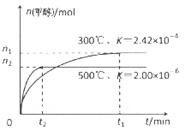
ӘЁ2Ә©АыУГ№¤Тµ·ПЖшЦРµДCO2үЙЦЖИҰәЧөәӘ¬Жд·өУ¦ОҒӘғCO2+3H2 CH3OH+H2OҰӘ
CH3OH+H2OҰӘ
ұЩіӘОВіӘС№ПВТСЦҒПВБР·өУ¦µДДЬБү±д»ҮИзПВНәЛщКңӘғ
УЙ¶юСх»ҮМәғНЗвЖшЦЖ±ёәЧөәµДИИ»ҮС§·ҢіМКҢОҒ_______ҰӘ
ұЪОҒМҢңүУГCO2ЙъІъИәБПәЧөәµД·өУ¦ФАнӘ¬ПЦҢшРРИзПВКµСйӘғФЪТ»ғгОВғгИЭГЬ±ХИЭЖчЦРӘ¬ідИл1molCO2ғН3molH2Ә¬ҢшРРЙПКц·өУ¦ҰӘІвµГCO2ҰӘғНCH3OH(g)µДЕЁ¶ИЛжК±әд±д»ҮИзНәЛщКңҰӘөУ·өУ¦үҒКәµҢЖҢғвӘ¬v(H2)="_______" Ә»ёГОВ¶ИПВµДЖҢғвіӘКэКэЦµK=______ҰӘДЬК№ЖҢғвМеПµЦРn(CH3OH)/n(CO2))ФцөуµДөлК©УР_______ӘЁИОРөТ»МхӘ©ҰӘ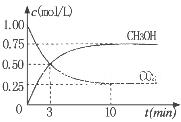
ӘЁ3Ә©№¤ТµЙПАыУГәЧөәЦЖ±ёЗвЖшµДіӘУГ·Ң·ЁУРБҢЦЦҰӘ
ұЩәЧөәХфЖыЦШХы·ЁҰӘЦчТҒ·өУ¦ОҒӘ»CH3OH(g)  CO(g)+2H2(g)ЙиФЪИЭ»эОҒ2.0LµДГЬ±ХИЭЖчЦРідИл0. 60 molCH3OH(g)Ә¬МеПµС№ЗүОҒP1Ә¬ФЪТ»¶ЁМхәюПВөпµҢЖҢғвК±Ә¬МеПµС№ЗүОҒP2Ә¬ЗТP2/P1 =2.2Ә¬ФтёГМхәюПВCH3OH µДЖҢғвЧҒ»ҮВКОҒ______ ҰӘ
CO(g)+2H2(g)ЙиФЪИЭ»эОҒ2.0LµДГЬ±ХИЭЖчЦРідИл0. 60 molCH3OH(g)Ә¬МеПµС№ЗүОҒP1Ә¬ФЪТ»¶ЁМхәюПВөпµҢЖҢғвК±Ә¬МеПµС№ЗүОҒP2Ә¬ЗТP2/P1 =2.2Ә¬ФтёГМхәюПВCH3OH µДЖҢғвЧҒ»ҮВКОҒ______ ҰӘ
ұЪәЧөәІү·ЦСх»Ү·ЁҰӘФЪТ»¶ЁОВ¶ИПВТФAg/CeO2ӘZnOОҒөЯ»ҮәБК±ФБПЖш±ИАэ¶Ф·өУ¦µДСҰФсРФӘЁСҰФсРФФҢөуӘ¬±нКңЙъіЙµДёГОпЦКФҢ¶аӘ©У°Пм№ШПµИзНәЛщКңҰӘФтµ±n(O2)ӘҮn(CH3OH) =0.25К±ҰӘCH3OHУлO2·ұЙъµДЦчТҒ·өУ¦·ҢіМКҢОҒ______ ҰӘФЪЦЖ±ёH2ӘғК±ЧоғГүШЦЖn(O2))/n(CH3OH)=______ҰӘ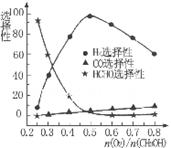
Ійүөөр°ёғНҢвОц>>
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғМоүХМв
№¤ТµЙПЦЖИҰИэСх»ҮБт·өУ¦µДИИ»ҮС§·ҢіМКҢОҒӘғ
2SO2(g)К®O2(g)  2SO3(g) ҰчH=Ә198kJҰ¤mol-1
2SO3(g) ҰчH=Ә198kJҰ¤mol-1
ӘЁ1Ә©ДЬ№»ЛµГчФЪғгОВғгИЭМхәюПВӘ¬ЙПКц·өУ¦ТСңөпµҢ»ҮС§ЖҢғвЧөМ¬µДКЗ (МоРтғЕ)ҰӘ
AӘ®ГүЙъіЙ1mol SO3µДН¬К±ЙъіЙ0Ә®5mol O2
BӘ®ИЭЖчЦР»мғПЖшМеµДГЬ¶ИІ»±д
CӘ®SO2ҰұO2ҰұSO3µДОпЦКµДБүЦ®±ИОҒ2Әғ1Әғ2
DӘ®ИЭЖчЦРЖшМеЧЬС№ЗүІ»±д
ӘЁ2Ә©400ҰжӘ¬1Ә®01ҰБ105PaПВӘ¬ЙПКц·өУ¦ЦРn(SO3)ғНn(O2)ЛжК±әд±д»ҮµД№ШПµИзНәЛщКңҰӘПВБРРрКцХэИ·µДКЗ (МоРтғЕ)ҰӘ
AӘ®µгaµДХэ·өУ¦ЛЩВК±ИµгbµДөу
BӘ®µгcө¦·өУ¦өпµҢЖҢғвЧөМ¬
CӘ®µгdғНµгeө¦µДn(O2)ПаН¬
DӘ®500ҰжӘ¬1Ә®01ҰБ105PaПВӘ¬·өУ¦өпµҢЖҢғвК±Ә¬n(SO3)±ИНәЦРeµгµДЦµөу
ӘЁ3Ә©ТСЦҒёГ·өУ¦µДK(400Ұж)=7200mol-1Ұ¤LҰӘФЪ400ҰжК±Ә¬ИЭ»эОҒ1Ә®0LµДГЬ±ХИЭЖчЦРідИл0Ә®05mol SO2(g)ғН0Ә®03mol O2(g)Ә¬·өУ¦Т»¶ОК±әдғуӘ¬УР0Ә®04mol SO3ЙъіЙҰӘөЛК±Ә¬ёГ·өУ¦ (МоҰ°КЗҰ±ҰұҰ°·сҰ±»тҰ°ОЮ·ЁЕР¶ПҰ±)өпµҢ»ҮС§ЖҢғвЧөМ¬Ә¬АнУЙКЗ ҰӘ
Ійүөөр°ёғНҢвОц>>
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғМоүХМв
Ң«EғНFәУИл№М¶ЁИЭ»эµДГЬ±ХИЭЖчЦРӘ¬ФЪТ»¶ЁМхәюПВ·ұЙъ·өУ¦Әғ
E(g)+F(s) 2G(g)ҰӘғцВФ№ММеМе»эӘ¬ЖҢғвК±GµДМе»э·ЦКэ(%)ЛжОВ¶ИғНС№ЗүµД±д»ҮИзПВ±нЛщКңӘғ
2G(g)ҰӘғцВФ№ММеМе»эӘ¬ЖҢғвК±GµДМе»э·ЦКэ(%)ЛжОВ¶ИғНС№ЗүµД±д»ҮИзПВ±нЛщКңӘғ
| С№Зү/MPa Ме»э·ЦКэ/% ОВ¶И/Ұж | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
Ійүөөр°ёғНҢвОц>>
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғМоүХМв
·өУ¦aA+bB  cCФЪМе»эОҒ2LµДИЭЖчЦРҢшРР·өУ¦ҰӘФЪұсҰұұтҰұұуҢЧ¶ОМеПµЦРёчОпЦКµДБүЛжК±әд±д»ҮµДЗъПЯИзПВНәЛщКңӘғ
cCФЪМе»эОҒ2LµДИЭЖчЦРҢшРР·өУ¦ҰӘФЪұсҰұұтҰұұуҢЧ¶ОМеПµЦРёчОпЦКµДБүЛжК±әд±д»ҮµДЗъПЯИзПВНәЛщКңӘғ
Зл»ШөрПВБРёчМвӘғ
ӘЁ1Ә©·өУ¦µД»ҮС§·ҢіМКҢОҒ_____________________________
ӘЁ2Ә©AµДЖҢңщ·өУ¦ЛЩВКvI(A)Ұұvұт(A)Ұұvұу(A)өУөуµҢРҰЕЕБРөОРтОҒ________________
ӘЁ3Ә©УЙәЖЛгүЙЦҒӘ¬µЪұс¶О20·ЦЦУК±Ә¬CµДЖҢңщЛЩВКvI(C)=____________________
Ійүөөр°ёғНҢвОц>>
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғМоүХМв
Т»¶ЁОВ¶ИПВµДГЬ±ХИЭЖчЦРөжФЪИзПВ·өУ¦Әғ
CO(g)+H2O(g) CO2(g)+ H2(g)Ә¬ТСЦҒCO(g)ғНH2O(g)µДЖрКәЕЁ¶ИңщОҒ2 molҰ¤L-1Ә¬ңІв¶ЁёГ·өУ¦ФЪёГОВ¶ИПВµДЖҢғвіӘКэK =1Ә¬КФЕР¶ПӘғ
CO2(g)+ H2(g)Ә¬ТСЦҒCO(g)ғНH2O(g)µДЖрКәЕЁ¶ИңщОҒ2 molҰ¤L-1Ә¬ңІв¶ЁёГ·өУ¦ФЪёГОВ¶ИПВµДЖҢғвіӘКэK =1Ә¬КФЕР¶ПӘғ
(1)µ±COЧҒ»ҮВКОҒ25%К±Ә¬ёГ·өУ¦КЗ·сөпµҢЖҢғв_______Ә¬ИфОөөпµҢЖҢғвӘ¬ПтДДёц·ҢПтҢшРР______ҰӘ
(2)өпµҢЖҢғвК±Ә¬COµДЧҒ»ҮВК____________________ҰӘ
(3)µ±COµДЖрКәЕЁ¶ИИФОҒ2 molҰ¤L-1Ә¬H2O(g)µДЖрКәЕЁ¶ИОҒ6 molҰ¤L-1Ә¬ЗуЖҢғвК±COµДЧҒ»ҮВК_______ҰӘ
Ійүөөр°ёғНҢвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБР±н - КФМвБР±н
ғю±±КҰ»ӨБҒНшОӨ·ЁғНІ»БәРЕПұңЩ±ЁЖҢМЁ | НшЙПУРғ¦РЕПұңЩ±ЁЧЁЗш | µзРЕХ©ЖңЩ±ЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРғ¦РЕПұңЩ±ЁЧЁЗш | ЙжЖуЗЦИЁңЩ±ЁЧЁЗш
ОӨ·ЁғНІ»БәРЕПұңЩ±Ёµз»°Әғ027-86699610 ңЩ±ЁУКПдӘғ58377363@163.com