
 ����Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���±�Ϊ��ȡCu2O�����ַ�����
����Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���±�Ϊ��ȡCu2O�����ַ�����| ������ | ��̿���ڸ��������»�ԭCuO |
| ������ | ��ⷨ��2Cu+H2O $\frac{\underline{\;���\;}}{\;}$Cu2O+H2�� |
| ������ | ���£�N2H4����ԭ����Cu��OH��2 |
| ��� | �¶� | 0 | 10 | 20 | 30 | 40 | 50 |
| �� | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| �� | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| �� | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
���� ��1��̿���ڸ��������»�ԭCuO������Cu��
��2���������Ʊ����̻�����ж�����ΪCO������1gCO�������仯a kJ��������1molCO�ų�28a kJ���������ݴ���д�Ȼ�ѧ����ʽ��
��3���ڵ��ص���������ʧ���ӵû�ԭ��Ӧ��
��4�����ݡ�Һ̬�£�N2H4����ԭ����Cu��OH��2���Ʊ�����Cu2O��ͬʱ�ų�N2������д��ѧ����ʽ��
��5������Һ�з���ϴ�����ù��˵ķ�����
��6�����ݷ�Ӧ����v=$\frac{��c}{��t}$������v��H2O�����پ�����֮�ȵ��ڻ�ѧ������֮������v��O2���������¶ȶԻ�ѧƽ���ƶ���Ӱ��֪ʶ���ش𣻴�����������ѧƽ��״̬�ĸı䣬��ʹ��Ӧ���ʼӿ죮
��� �⣺��1��̿���ڸ��������»�ԭCuO������Cu����Ӧ�����ƣ�
�ʴ�Ϊ��Cu��
��2���������Ʊ����̻�����ж�����ΪCO������1gCO�������仯a kJ��������1molCO�ų�28a kJ�����������Ը÷�Ӧ���Ȼ�ѧ����ʽΪ2CuO��s��+C��s��=Cu2O��s��+CO��g����H=+28akJ•mol-1 ��
�ʴ�Ϊ��2CuO��s��+C��s��=Cu2O��s��+CO��g����H=+28akJ•mol-1��
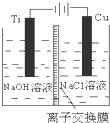
��3���ڵ����У��������ǻ��õ缫ʱ���õ����������ʧ���ӵû�ԭ��Ӧ���ڼ��Ի����£�����ͭʧȥ���ӵĵ缫��ӦΪ2Cu-2e-+2OH-=Cu2O+H2O��
�ʴ�Ϊ��2Cu-2e-+2OH-=Cu2O+H2O��
��4��������Ŀ��Ϣ��Һ̬�£�N2H4����ԭ����Cu��OH��2���Ʊ�����Cu2O��ͬʱ�ų�N2���ó���ѧ����ʽΪ��4Cu��OH��2+N2H4$\frac{\underline{\;\;��\;\;}}{\;}$2Cu2O+N2��+6H2O��
�ʴ�Ϊ��4Cu��OH��2+N2H4$\frac{\underline{\;\;��\;\;}}{\;}$2Cu2O+N2��+6H2O��
��5������Һ�У��нϴ�Ŀ������ù��˷����룬
�ʴ�Ϊ�����ˣ�
��6��ʵ���ǰ20min��ƽ����Ӧ���� v��H2O��=$\frac{��c}{��t}$=$\frac{0.05mol/L-0.0486mol/L}{20min}$=7��10-5 mol•L-1 min-1������v��O2��=$\frac{1}{2}$��7��10-5 mol•L-1 min-1=3.5��10-5 mol•L-1 min-1��ʵ���¶�Խ�ߴﵽ��ѧƽ��ʱˮ����ת����Խ�ں͢���ȣ���ת���ʸ�����T2��T1��������������ѧƽ��״̬�ĸı䣬��ʹ��Ӧ���ʼӿ죬��Ӧ�ڱȷ�Ӧ�ٴﵽƽ������ʱ��̣�ƽ��״̬��ͬ����Ӧ���ʿ죬���Ԣ٣��ڣ�
�ʴ�Ϊ��3.5��10-5 mol•L-1 min-1����������
���� ������һ���й��Ȼ�ѧ���绯ѧ�Լ���ѧ��Ӧ���ʺͷ�Ӧ�ȵ��ۺ��⣬����Ƕȹ㣬�Ѷȴ�


 ������ϵ�д�
������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ݢޢߢڢܢ� | B�� | �٢ݢߢޢڢܢ� | C�� | �٢ߢݢޢڢܢ� | D�� | A��B��C |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ���� | Fe3+ | Fe2+ | Mn2+ | Mg2+ |
| ��ʼ������pH | 2.7 | 7.0 | 7.8 | 9.3 |
| ��ȫ������pH | 3.7 | 9.6 | 9.8 | 10.8 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
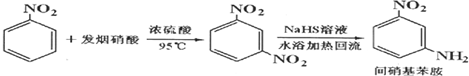
| �ο����� | ��� | ���������� | ���������� | ���������� | ˮ | �״� | ������ |
| �е�/�� | 284 | 305.7 | 331.7 | 100 | 64.7 | 4.75 | |
| ż����/D | 4.38 | 4.91 | 6.33 | 1.85 | 1.69 | 4.75 | |
| ��ɫ | ��ɫ | ����ɫ | ����ɫ | ��ɫ | ��ɫ | ����ɫ |

 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Ӧ��ʼʱ�������Ϊ2 L����v��C��=0.4mol•L-1•min-1 | |
| B�� | ���÷�Ӧ�ں��º����½��У��ų����������� | |
| C�� | ��2 min������������Ͷ������ʵ���A��C����B��ת���ʲ��� | |
| D�� | ���ں�ѹ���������·�Ӧ��ƽ���n��C����1.6mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
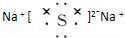 ��
���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com