
【题目】I.SO2是造成空气污染的主要原因之一,可以Na2SO3溶液为吸收液除SO2。
(1)该反应的离子方程式是_____________________________________________________。
(2)已知NaHSO3溶液显酸性,请结合离子方程式,用盐的水解和电离理论进行解释:_______________________________________________________________________。
(3)在Na2SO3稀溶液中各离子浓度从大到小排列顺序是___________________________。
(4)往Na2SO3稀溶液加入少量KOH固体,完全溶解后(忽略溶解过程中溶液温度变化)溶液中c(Na+) : c(SO32-) 的比值____________(填“变大”、“变小”或“保持不变”)。
II.工业上常用SO2除去原料气中少量CO,生成物为固体S和CO2。
(5)写出该反应的化学方程式为_______________________。
(6)上述反应中,每减少2.24L气体(标准状况下),转移电子数为_____。
(7)上述反应所涉及的3种元素中,原子半径从大到小的排列顺序为_________;三种元素非金属性由强到弱的顺序为____________;反应所涉及的化合物中仅有一种是非极性分子,其电子式为_____________。
【答案】SO32- + SO2 + H2O = 2HSO3- HSO3-在溶液中既能电离出氢离子,HSO3- H+ + SO32-,同时HSO3-也能水解生成氢氧根,HSO3- + H2O OH- + H2SO3,由于HSO3-的电离程度大于水解程度,所以溶液显酸性 c(Na+)> c(SO32-)> c(OH-)> c(HSO3-)> c(H+) 变小 SO2+2CO=S+2CO2 0.4NA S>C>O O>S>C ![]()
【解析】
I(1)Na2SO3溶液吸收SO2能生成亚硫酸氢钠;
(2)HSO3-在溶液中既能电离出氢离子,同时HSO3-也能水解生成氢氧根,由于HSO3-的电离程度大于水解程度,所以溶液显酸性;
(3)先写出Na2SO3稀溶液中的所有的电离、水解方程式,比较电离和水解程度的大小,进而比较离子的大小顺序;
(4)利用水解平衡移动进行分析;
II.(5)根据已知信息确定反应物为SO2和CO,生成物为S和CO2,根据得失电子守恒、元素守恒,写出该反应的化学方程式;
(6)在该反应SO2+2CO=S+2CO2中,S为固体,其余为气体,当有1molSO2和2molCO反应生成1molS固体和2molCO2气体时,气体减少1mol,此时转移电子数为4NA,据此分析;
(7)一般电子层数越多原子半径越大,电子层数相同时核电荷数越多半径越小;同周期元素从左至右非金属逐渐增强,同主族元素从上至下,非金属性逐渐减弱,据此分析;
I.(1)Na2SO3溶液吸收SO2能生成亚硫酸氢钠,反应的离子方程式是SO32- + SO2 + H2O = 2HSO3-;
故答案为:SO32- + SO2 + H2O = 2HSO3-;
(2)HSO3-在溶液中既能电离出氢离子HSO3- H+ + SO32-,同时HSO3-也能水解生成氢氧根, HSO3- + H2O OH- + H2SO3,由于HSO3-的电离程度大于水解程度,所以溶液显酸性;
故答案为:HSO3-在溶液中既能电离出氢离子,HSO3- H+ + SO32-,同时HSO3-也能水解生成氢氧根,HSO3- + H2O OH- + H2SO3,由于HSO3-的电离程度大于水解程度,所以溶液显酸性;
(3)在Na2SO3稀溶液中,按电离和水解程度的大小顺序依次排列为:
Na2SO3 = 2Na+ + SO32-;
SO32- + H2O OH- + HSO3-;
HSO3- + H2O OH- + H2SO3,
H2O OH- + H+;
则Na2SO3稀溶液中各离子浓度从大到小排列顺序是c(Na+)> c(SO32-)> c(OH-)> c(HSO3-)> c(H+);
故答案为:c(Na+)> c(SO32-)> c(OH-)> c(HSO3-)> c(H+);
(4)在Na2SO3稀溶液中存在SO32-的水解平衡:SO32- + H2O OH- + HSO3-,当加入少量KOH固体后,c(OH-)增大,平衡逆向移动,c(SO32-)增大,c(Na+)不变,则c(Na+) : c(SO32-) 的比值变小;
故答案为:变小;
II.(5)根据已知信息确定反应物为SO2和CO,生成物为S和CO2,根据得失电子守恒、元素守恒,写出该反应的化学方程式为SO2+2CO=S+2CO2;
故答案为:SO2+2CO=S+2CO2;
(6)在该反应SO2+2CO=S+2CO2中,S为固体,其余为气体,当有1molSO2和2molCO反应生成1molS固体和2molCO2气体时,气体减少1mol,此时转移电子数为4NA,则当减少
故答案为:0.4NA;
(7)上述反应所涉及的3种元素为S、C、O,一般电子层数越多原子半径越大,电子层数相同时核电荷数越多半径越小,则原子半径从大到小的排列顺序为S>C>O;三种元素非金属性由强到弱的顺序为O>S>C;反应涉及的化合物中CO2是非极性分子,其电子式为![]() ;
;
故答案为:S>C>O;O>S>C;![]() 。
。


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是
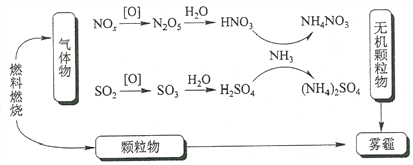
A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式为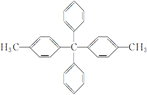 ,对该有机物分子的描述正确的是( )
,对该有机物分子的描述正确的是( )
A. 最多有7个碳原子共线
B. 所有碳原子都在同一平面上
C. 其一氯代物最多有5种
D. 最多有25个原子共面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某容积固定的密闭容器中加入0.3molA、0.1molC和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答下列问题。
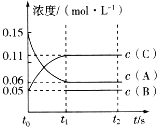
(1)密闭容器的容积是___L。
(2)若t1=15s,则t0~t1阶段以C物质浓度变化表示的反应速率为v(C)=___。
(3)写出反应的化学方程式:___。
(4)B的起始物质的量是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是另一种元素周期表——三角形元素周期表的一部分,图中标示了L、M、Q、R、T元素的位置,下列判断正确的是
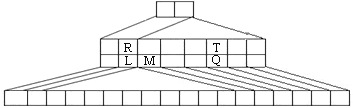
A.Q、T两元素的氢化物的稳定性为HnT<HnQ
B.L、R的单质与盐酸反应速率为R>L
C.M与T形成的化合物有两性
D.L、Q形成的简单离子核外电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答以下问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ⑩ | ② | |||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
四 | ⑧ | ⑨ |
(1)在这些元素中,最活泼的非金属元素是___(元素符号),原子最外层达到稳定结构的元素是__(元素符号);
(2)元素的最高价氧化物对应的水化物中酸性最强的是____(填化学式);
(3)写出④的氧化物与③的最高价氧化物对应的水化物相互反应的化学方程式_____;
(4)③、⑥、⑧的原子半径由大到小为__﹥___﹥__/span>(填元素符号)①、⑤的最高价含氧酸酸性__﹥__(均填化学式);
(5)写出证明非金属性⑥比⑨强(用置换反应证明)的化学方程式________;
(6)写出实验室制备⑩的氢化物的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用阳极![]() 和阴极
和阴极![]() 电解
电解![]() 的水溶液,电解一段时间后,再加入
的水溶液,电解一段时间后,再加入![]() ,能使溶液恢复到电解前的状态,符合题意的一组是
,能使溶液恢复到电解前的状态,符合题意的一组是
|
|
|
| |
A |
|
|
|
|
B |
|
|
|
|
C |
|
|
|
|
D |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.10 mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积为V,pH随lg![]() 的变化如图所示。下列叙述错误的是( )
的变化如图所示。下列叙述错误的是( )
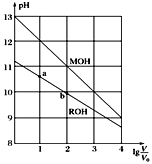
A. 当lg![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则![]() 增大
增大
B. MOH的碱性强于ROH的碱性
C. ROH的电离程度:b点大于a点
D. 若两溶液无限稀释,则它们的c(OH-)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,恒容密闭容器中发生N2(g)+3H2(g)![]() 2NH3(g)反应,反应速率与反应时间的关系如图所示。对两种平衡状态下各物理量的比较错误的是( )
2NH3(g)反应,反应速率与反应时间的关系如图所示。对两种平衡状态下各物理量的比较错误的是( )

A.平衡状态Ⅱ时的c(H2)一定小B.平衡状态Ⅱ时的c(NH3)一定大
C.平衡常数K一样大D.平衡状态Ⅱ时的v(正)一定大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com