
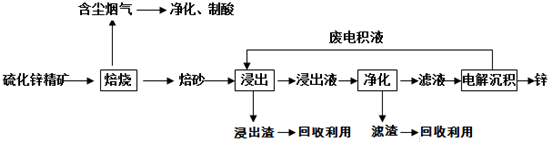
分析 硫化锌精矿的焙烧可生成ZnO、氧化铁等,含尘烟气含有含硫氧化物,可用于制备硫酸,浸出液加入硫酸可生成硫酸锌、硫酸铁,加入过量锌充分反应,可置换出铁,滤液中主要含有硫酸锌,经电解可得到锌和硫酸,电解液中含有硫酸,可循环利用;
(1)含锌矿的主要成分是ZnS,与空气中氧气发生氧化还原反应,判断焙砂的主要成分为氧化锌;
(2)焙烧生成的含硫氧化物可转换为硫酸;
(3)该含锌矿中还含有FeS等杂质,浸出操作后转化为亚铁离子,可加入锌粉出去亚铁离子,从而除去Fe;
(4)电解沉积过程中,是电解ZnSO4,阳极上是氢氧根离子失电子发生氧化反应;
(5)“氧压酸浸”法顾名思义,可知反应物中含有H+和O2,可以获得非金属单质S,根据反应物和生成物写出化学方程式;
(6)根据沉淀的转化原理可知,在一定条件下,溶解度小的矿物可以转化为溶解度更小的矿物;
(7)根据题目描述可知反应物为ZnCO3和C,产物含有Zn,根据反应物和生成物写出化学方程式.
解答 解:硫化锌精矿的焙烧可生成ZnO、氧化铁等,含尘烟气含有含硫氧化物,可用于制备硫酸,浸出液加入硫酸可生成硫酸锌、硫酸铁,加入过量锌充分反应,可置换出铁,滤液中主要含有硫酸锌,经电解可得到锌和硫酸,电解液中含有硫酸,可循环利用;
(1)含锌矿的主要成分是ZnS,与空气中氧气发生氧化还原反应,则焙砂的主要成分为ZnO,
故答案为:ZnO;
(2)焙烧生成的含硫氧化物可转换为硫酸,用于后续的浸出操作,
故答案为:浸出;
(3)该含锌矿中还含有FeS等杂质,浸出操作后转化为亚铁离子,可加入锌粉出去亚铁离子,从而除去Fe,反应的离子方程式为Zn+Fe2+=Zn2++Fe,
故答案为:置换出Fe等;Zn+Fe2+=Zn2++Fe;
(4)电解沉积过程中,是电解ZnSO4,阴极锌离子放电生成锌,阳极发生氧化反应,产物为O2,故答案为:O2;
(5)“氧压酸浸”法顾名思义,可知反应物中含有H+和O2,可以获得非金属单质S,写出化学方程式为:2ZnS+4H++O2=2Zn2++2S↓+2H2O;
故答案为:2ZnS+4H++O2=2Zn2++2S↓+2H2O;
(6)根据沉淀的转化原理可知,在一定条件下,溶解度小的矿物可以转化为溶解度更小的矿物,所以硫化锌精矿(ZnS)遇到硫酸铜溶液可慢慢地转变为铜蓝(CuS),
故答案为:在一定条件下,溶解度小的矿物可以转化为溶解度更小的矿物(或在相同条件下,由于KSP(CuS)小于KSP(ZnS),故反应可以发生);
(7)根据题目描述可知反应物为ZnCO3和C,产物含有Zn,则化学方程式为ZnCO3+2C$\frac{\underline{\;高温\;}}{\;}$Zn+3CO↑,故答案为:ZnCO3+2C$\frac{\underline{\;高温\;}}{\;}$Zn+3CO↑.
点评 本题难度中等,掌握氧化物的特征、利用化合价的原则计算指定元素的化合价的方法、化学方程式的书写方法、含杂质物质的化学方程式的计算等是正确解答本题的关键.


科目:高中化学 来源: 题型:解答题
 化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.
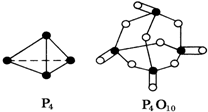
化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.| 化学键 | P-P | P-O | O═O | P═O |
| 键能KJ/mol | 197 | 360 | 499 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯的结构简式:CH3CH2COOCH3 | |
| B. | 丙烯的键线式 | |
| C. | 乙醇的结构式: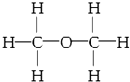 | |
| D. | 乙烯的结构简式:CH2=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2是淡黄色固体,久置于空气中变成Na2O | |
| B. | Na2O2与水的反应中,Na2O2只作氧化剂 | |
| C. | 用0.1mol Na2O2与足量水反应转移的电子的物质的量为0.2mol | |
| D. | Na2O2放入饱和NaOH溶液中,放出大量的O2,并有白色固体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
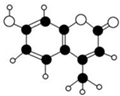 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示.对于该有机物,下列有关叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示.对于该有机物,下列有关叙述正确的是( )| A. | 该物质不能与浓溴水发生取代反应 | |
| B. | 1mol该物质最多能与5mol H2加成 | |
| C. | 该物质能使酸性KMnO4溶液褪色 | |
| D. | 1mol该物质最多能与含2mol NaOH的溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发生物质能替代化石燃料 | B. | 向高空排放金属冶炼产生的粉尘 | ||
| C. | 用催化转化技术处理汽车尾气 | D. | 大力推广生产和使用无氟冰箱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 500 | 4600 | 6900 | 9500 |
| B | 740 | 1500 | 7700 | 10500 |
| C | 580 | 1800 | 2700 | 11600 |
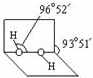 分子中氧原子采取sp3杂化;通常情况下,H2O2与水任意比互溶的主要原因是H2O2分子与水分子间形成氢键,使H2O2与水任意比互溶.
分子中氧原子采取sp3杂化;通常情况下,H2O2与水任意比互溶的主要原因是H2O2分子与水分子间形成氢键,使H2O2与水任意比互溶.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:丁>丙>乙 | |
| B. | 81号元素铊与丙元素处同主族,则铊的最高价氧化物对应水化物呈两性 | |
| C. | 电解法可以用乙与丙形成的化合物制得丙单质 | |
| D. | 同周期元素中丁的最高价氧化物对应水化物的酸性最强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com