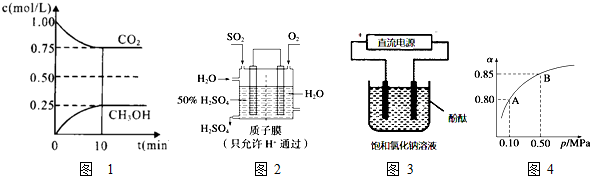
分析:(1)①根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
②要使
增大,就是改变条件使平衡正向移动,由此分析解答;
③用三行式来求平衡时的各组分浓度,然后代入平衡常数表达式求解,要注意代入平衡常数表达式是平衡浓度,平衡常数是温度的函数,温度变平衡常数才变,到底如何变,还要看反应的热效应;
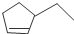
(2)①原电池负极发生氧化反应,SO
2被氧化生成SO
42-;
②整个电路中转移电子的数目相等,可以根据电子转移的数目相同来列出已知物质和未知物质之间关系式,然后通过关系来求解;
(3)平衡常数随温度变化,不随压强变化;
(4)计算混合后硫酸根的浓度,根据K
sp(BaSO
4)=c(Ba
2+)?c(SO
42-)计算硫酸根沉淀时溶液中c(Ba
2+),原氯化钡溶液为此时钡离子浓度的2倍,注意溶液混合后各种物质的浓度降为原来的一半;
(5)升高温度,加快反应速率到达平均的时间缩短,逆反应速率增大更多,平衡向逆反应方向移动,三氧化硫的含量降低;增大压强,加快反应速率到达平均的时间缩短,正反应速率增大更多,平衡向正反应方向移动,三氧化硫的含量增大,据此结合图象判断.
解答:
解:(1)①A.CO
2的体积分数在混合气体中保持不变,说明正逆反应速率相等,达化学平衡状态,故AA正确;
B.混合气体的密度一直不变化,故B错误;
C.单位时间内每消耗1.2mol H
2,同时生成0.4molH
2O,都体现正向,未体现正与逆的关系,故C错误;
D.反应中H
2O与CH
3OH的物质的量浓度之比从反应开始到平衡都为1:1,且保持不变,故D错误;
故选:A;
②要使
增大,就是改变条件使平衡正向移动,
A.升高温度,正反应是放热反应,平衡逆向移动,故错误;
B.恒温恒容下充入He(g),平衡不移动,故错误;
C.将H
2O(g)从体系中分离,平衡正向移动,比值变大,故正确;
D.恒温恒容再充入2mol CO
2和3mol H
2,相当于增大压强,平衡正向移动,故正确;故选CD;
③CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g)
初始(mol/L) 1 1.5 0 0
变化(mol/L) 0.25 0.75 0.25 0.25
平衡(mol/L) 0.75 0.75 0.25 0.25
所以 K=
=0.20,
而平衡常数是温度的函数,只有通过改变温度,来改变平衡常数,正反应量放热反应,降低温度,K值变大,
故答案为:0.20;C;
(2)①原电池负极发生氧化反应,SO
2被氧化生成SO
42-,负极电极反应式为SO
2+2H
2O-2e
-=SO
42-+4H
+,
故答案为:SO
2+2H
2O-2e
-=SO
42-+4H
+;
②用惰性电极,电解饱和食盐水总的电极反应式为2Cl
-+2H
2O
H
2↑+Cl
2↑+2 OH
-,pH值变为13时,pOH=1,C(OH
-)=10
-1mol/L,n(OH
-)=10
-1mol/L×300mL×10
-3L/mL=0.03mol,由方程式CH
3OH-6e
-+H
2O=CO
2+6H
+,2Cl
-+2H
2O
H
2↑+Cl
2↑+2 OH
- 可知 SO
2~2e
-~2OH
- 64g 2mol
m(SO
2) 0.03mol
则m(SO
2)=64g×0.03mol÷2mol=0.96g,
故答案为:2Cl
-+2H
2O
H
2↑+Cl
2↑+2 OH
-;0.96g;
(3)平衡常数只与温度有关,与压强无关,在温度不变的条件下,无论压强怎样变化,平衡常数都不变,
故答案为:=;
(4)等体积混合后,c(SO
42-)=
×2.0×10
-3mol/L=1.0×10
-3mol/L,故BaSO
4沉淀所需Ba
2+离子的最小浓度为c(Ba
2+)=
mol/L=1.08×10
-7mol/L,故原BaCl
2溶液的浓度为2×1.08×10
-7mol/L=2.16×10
-7mol/L,故答案为:2.16×10
-7mol/L;
(5)A.升高温度,逆反应速率增大更多,平衡向逆反应方向移动,图象与实际符合,故A正确;
B.升高温度,平衡向逆反应方向移动,三氧化硫的含量降低,图象与实际符合,故B正确;
C.升高温度,加快反应速率到达平均的时间缩短,逆反应速率增大更多,平衡向逆反应方向移动,三氧化硫的含量降低,图象与实际不符,故C错误;
D.增大压强,加快反应速率到达平均的时间缩短,正反应速率增大更多,平衡向正反应方向移动,三氧化硫的含量增大,图象与实际符合,故D正确;
故答案为:ABD.