
 前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2.
前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2. ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③$\sqrt{2}$、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③$\sqrt{2}$、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.分析 前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,则A为碳元素、B为N元素;C、D、E、F是位于同一周期的金属元素,只能处于第四周期,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,可推知C为K、F为Cu,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2,D、E价电子排布分别为3d64s2,3d84s2,故D为Fe、E为Ni,据此解答.
(1)金属性越强,其第一电离能最小,非金属性越强电负性越大;
(2)黄血盐的化学式K4[Fe(CN)6],CN-与氮气互为等电子体,CN-中存在C≡N三键,黄血盐晶体中含有离子键、配位键、共价键;
(3)Ni2+的价层电子排布式为3d8,据此书写价电子排布图;
确定C原子价层电子对数、孤电子对,判断C原子杂化方式、HCHO分子的立体结构,甲醛与氢气的加成产物为甲醇,甲醇分子之间形成氢键,其熔、沸点比CH4的高;
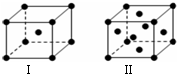
(4)金属K晶体为体心立方堆积,晶胞结构为图Ⅰ,晶胞中K原子配位数为8,金属Cu晶体为面心立方最密堆积,晶胞结构为图Ⅱ,以顶点Cu原子研究与之最近的原子位于面心,每个顶点Cu原子为12个面共用,晶胞中Cu原子配位数为12;
利用均摊法计算金属K的晶胞中K原子数目,进而计算晶胞质量,根据V=$\frac{m}{ρ}$计算晶胞体积,可得晶胞棱长,设K原子半径为r,则晶胞体对角线长度=4r,利用体对角线与棱长关系列方程计算解答.
解答 解:前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,则A为碳元素、B为N元素;C、D、E、F是位于同一周期的金属元素,只能处于第四周期,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,可推知C为K、F为Cu,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2,D、E价电子排布分别为3d64s2,3d84s2,故D为Fe、E为Ni,
(1)六种元素中K的金属性最强,其第一电离能最小,非金属性越强电负性越大,故电负性最大的是N,
故答案为:K;N;
(2)黄血盐的化学式K4[Fe(CN)6],CN-与氮气互为等电子体,CN-中存在C≡N三键,故1mol CN-中含有π键的数目为2NA,黄血盐晶体中含有离子键、配位键、共价键,没有金属键、氢键、分子间的作用力,
故答案为:K4[Fe(CN)6];2NA;def;
(3)Ni2+的价层电子排布式为3d8,故价电子排布图为
①CH2=CH2、③
故答案为:
(4)金属K晶体为体心立方堆积,晶胞结构为图Ⅰ,晶胞中K原子配位数为8,金属Cu晶体为面心立方最密堆积,晶胞结构为图Ⅱ,以顶点Cu原子研究与之最近的原子位于面心,每个顶点Cu原子为12个面共用,晶胞中Cu原子配位数为12,K、Cu两种晶体晶胞中金属原子的配位数之比为 8:12=2:3;
金属K的晶胞中,K原子数目=1+8×$\frac{1}{8}$=2,若K原子的摩尔质量为M,阿伏加得罗常数为NA,则晶胞质量=$\frac{2M}{{N}_{A}}$g,设该晶胞的密度为a g/cm3,则晶胞体积=$\frac{\frac{2M}{{N}_{A}}g}{ag/c{m}^{3}}$=$\frac{2M}{a{N}_{A}}$cm3,晶胞棱长=$\root{3}{\frac{2M}{{aN}_{A}}}$cm,设K原子半径为r,则晶胞体对角线长度=4r,故3($\root{3}{\frac{2M}{a{N}_{A}}}$cm)2=(4r)2,故r=$\frac{\sqrt{3}}{4}\root{3}{\frac{2M}{{aN}_{A}}}$cm,
故答案为:2:3;$\frac{\sqrt{3}}{4}\root{3}{\frac{2M}{{aN}_{A}}}$cm.
点评 本题是对物质结构的考查,涉及元素推断、核外电子排布、电离能、电负性、配合物、化学键、杂化轨道、晶胞计算等,需要学生熟记晶胞结构,对学生的空间想象及数学计算具有一定的要求,难点中等.


科目:高中化学 来源: 题型:选择题
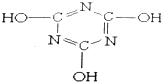
| A. | 分子式为C3H3N303 | B. | 属于共价化合物 | ||
| C. | 分子中只含极性键,不含非极性键 | D. | 该分子中的C原子采取sp3杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碱式硫酸铬可用于皮革、印染等行业.
碱式硫酸铬可用于皮革、印染等行业.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+ MnO4- Na+ Cl- | B. | K+ Na+ NO3- CO32- | ||
| C. | Na+ H+ NO3- SO42- | D. | Fe3+ Na+ Cl- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液的溶质不可能是NaHSO4 | |
| B. | 向该溶液中加入铝粉,一定能产生大量H2 | |
| C. | 下列离子在该溶液中一定能大量共存:Cl-、K+、Cu2+ | |
| D. | 向该溶液中加入NaHCO3固体,一定有化学反应发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯和水,酒精和水,植物油和水 | |
| B. | 四氯化碳和水,溴苯和水,硝基苯和水 | |
| C. | 甘油和水,乙酸和水,乙酸和乙醇 | |
| D. | 汽油和水,溴苯和水,苯酚和酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
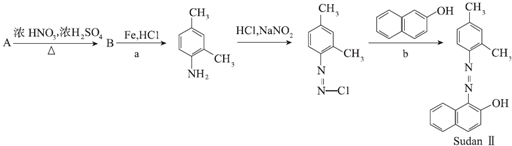
 .
.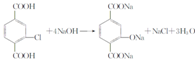 .②E→Fn
.②E→Fn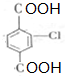 +nHOCH2CH2OH$→_{△}^{浓硫酸}$
+nHOCH2CH2OH$→_{△}^{浓硫酸}$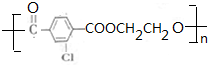 +2nH2O.
+2nH2O. 和另一种含氮有机分子G,G分子既能与氢氧化钠溶液反应,也能与盐酸反应.G分子中氮元素的质量分数为8.8%.
和另一种含氮有机分子G,G分子既能与氢氧化钠溶液反应,也能与盐酸反应.G分子中氮元素的质量分数为8.8%.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫酸亚铁铵[(NH4)2Fe(SO4)2•6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁.硫酸亚铁铵在 500℃时隔绝空气加热完全分解.回答下列问题:
硫酸亚铁铵[(NH4)2Fe(SO4)2•6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁.硫酸亚铁铵在 500℃时隔绝空气加热完全分解.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com