
| A. | △H1>△H2>△H3 | B. | △H2<△H3<△H1 | C. | △H1=△H2=△H3 | D. | △H2>△H3>△H1 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
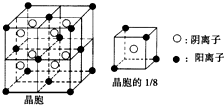 A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大.B、C、D同周期,A、D同主族,E和其他元素既不在同周期也不在同主族.B、C、D的最高价氧化物对应水化物均能互相发生反应生成盐和水.A和E可形成离子化合物,其晶胞结构如图所示.
A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大.B、C、D同周期,A、D同主族,E和其他元素既不在同周期也不在同主族.B、C、D的最高价氧化物对应水化物均能互相发生反应生成盐和水.A和E可形成离子化合物,其晶胞结构如图所示. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
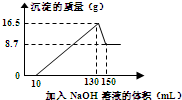 将一定量的铝镁合金投入到一定浓度的100mL盐酸中,合金全部溶解.向所得溶液中滴加5mol•L-1NaOH溶液至过量,生成沉淀的质量与加入NaOH溶液的体积关系如图所示.试计算:
将一定量的铝镁合金投入到一定浓度的100mL盐酸中,合金全部溶解.向所得溶液中滴加5mol•L-1NaOH溶液至过量,生成沉淀的质量与加入NaOH溶液的体积关系如图所示.试计算:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原电池是直接把化学能转化为电能的装置.
原电池是直接把化学能转化为电能的装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 C2H4 | B. | CH4 C3H6 | C. | C2H4 C3H4 | D. | C2H4 CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
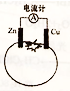
| A. | 一段时间后,锌片质量会减少 | B. | 一段时间后,铜片质量会减少 | ||
| C. | 电流由铜通过导线流向锌 | D. | 锌电极是该电池的负极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com