
| A. | 非自发反应在任何情况下都不会发生 | |
| B. | 室温下不能自发进行的反应,在高温下有可能自发进行 | |
| C. | 温度、压强一定时,吸热的熵增反应一定能够自发进行 | |
| D. | 固体的溶解过程与熵变无关 |
分析 A.非自发反应在一定条件下也可以发生;
B.反应能否自发进行,取决于=△H-T•△S的差值,当△H-T•△S<0时,反应能自发进行,否则不能;
C.温度、压强一定时,反应方向的判据是△G=△H-T△S,△G>0反应不能自发进行,△G<0反应能自发进行,△G=0达到平衡;
D.固体溶解分子或离子扩散到溶剂,微粒的混乱度增大.
解答 解:A.水分解非自发,但可以电解生成氢气和氧气,故A错误;
B.室温下不能自发进行的反应,如升高温度,使△H-T•△S<0时,有可能自发进行,如碳酸钙的分解,故B正确;
C.吸热反应△H>0,熵增加的反应,△S>0,低温下△H-T△S不一定小于0,反应不一定能自发进行,故C错误;
D.固体的溶解过程是熵值增加的过程,故D错误;
故选B.
点评 本题考查反应热、焓变和熵变,题目侧重于化学反应自发进行方向的综合考查,为该考高频考点,题目难度不大,注意反应能否自发进行取决于焓变和熵变的综合判据.


科目:高中化学 来源: 题型:选择题
| A. | 铁与稀HNO3反应:Fe+2H+═Fe2++H2↑ | |
| B. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| C. | 氯化钙与碳酸氢钾溶液混合:Ca2++CO32-═CaCO3↓ | |
| D. | 向小苏打溶液中加入过量的澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ②
②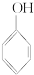 ③
③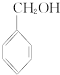 ④
④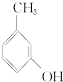 ⑤NaHSO 3溶液
⑤NaHSO 3溶液 查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cl2+2NaOH═NaCl+NaClO+H2O | B. | Fe+CuSO4═FeSO4+Cu | ||
| C. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | D. | 3NO2+H2O=2HNO3+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 质子数为17、中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| B. | 氯离子(Cl-)的结构示意图: | |
| C. | 氯分子的电子式: | |
| D. | 氯化氢的结构式:H-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
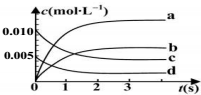 在2L密闭容器内,800℃时反应:2N0(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应:2N0(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| N(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL 5% H2O2溶液,各滴入2滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡; 试管B中产生的气泡量增大. |
| ② | 另取两支试管分别加入5mL 5% H2O2溶液和5mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生. |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 +(2n-1)H2O.
+(2n-1)H2O.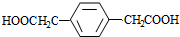 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com