
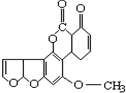
| A. | 1mol该化合物最多消耗H2和NaOH分别为6 mol和2 mol | |
| B. | 该化合物中含有三种官能团 | |
| C. | 该化合物中含有2个苯环结构 | |
| D. | 该化合物可以和1mol Br2发生加成反应 |
分析 A.苯环和碳碳双键能和氢气发生加成反应、酯基水解生成的羧基、酚羟基能和NaOH反应;
B.该有机物中含有碳碳双键、醚键、酯基和羰基;
C.该分子中只有一个苯环;
D.碳碳双键能和溴发生加成反应.
解答 解:A.苯环和碳碳双键能和氢气发生加成反应、酯基水解生成的羧基、酚羟基能和NaOH反应,所以1mol该化合物最多消耗H2和NaOH分别为6 mol和2 mol,故A正确;
B.该有机物中含有碳碳双键、醚键、酯基和羰基四种官能团,故B错误;
C.该分子中只有一个苯环,故C错误;
D.碳碳双键能和溴发生加成反应,含有2个碳碳双键,所以该化合物可以和2mol Br2发生加成反应,故D错误;
故选A.
点评 本题考查有机物结构和性质,为高频考点,把握官能团及其性质关系是解本题关键,侧重考查酯、烯烃等性质,易错选项是A.


科目:高中化学 来源: 题型:解答题
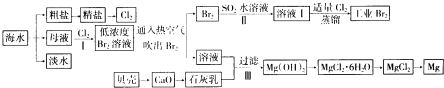
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
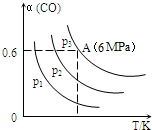
| A. | p1>p2>p3 | |
| B. | 若断裂碳氢键、氢氢键的速率相等,则该反应为平衡状态 | |
| C. | 已知从反应开始到平衡点A需要时间10min.在0~10分钟内的平均速率v(H2)=0.18mol/(L•min) | |
| D. | A点的平衡常数Kp=$\frac{1}{64}$(Kp是用平衡时各组分的分压代替其浓度的平衡常数.组分分压=混合气体总压强X该组分的物质的量分数) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
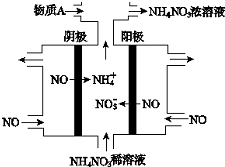
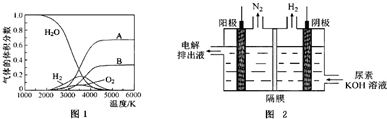
| A. | 阳极上的电极反应为:NO•3e-+4OH-=NO3-+2H2O | |
| B. | 电解生成1 mol NH4NO3 时,转移5NA电子 | |
| C. | 电解质溶液中,NO3-离子向阴极移动 | |
| D. | 为了使电解产物全部转化为NH4NO3,需补充的物质A为稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 无法确定原试液中是否含有Fe3+、K+ | |
| B. | 滤液X中大量存在的阳离子有NH4+、Fe3+、H+和Al3+ | |
| C. | 无法确定沉淀B的成分 | |
| D. | 原溶液中一定存在的离子为NH4+、Fe2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列说法正确的是( )
下列说法正确的是( )| A. | ①② | B. | ①③④ | C. | ③④⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com