
分析 (1)密度不同,可利用水冲洗法分离;
(2)铁能被磁铁吸引;
(3)泥沙不溶于水;
(4)食盐溶于水,为可溶性固体与液体分离;
(5)自来水中水的沸点较低;
(6)KNO3和NaCl的溶解度受温度影响不同.
解答 解:(1)利用密度不同将金子与沙子分离密度不同,可水冲洗法分离,故答案为:密度不同;
(2)铁能被磁铁吸引,则利用磁铁分离铁屑和沙子,故答案为:磁铁;
(3)泥沙不溶于水,则选择过滤法分离,故答案为:过滤;
(4)食盐溶于水,为可溶性固体与液体分离,则利用蒸发分离,故答案为:蒸发;
(5)自来水中水的沸点较低,选择蒸馏法制取,故答案为:蒸馏;
(6)KNO3和NaCl的溶解度受温度影响不同,则选择结晶法获得KNO3,故答案为:结晶.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、混合物分离方法的选择为解答的关键,侧重分析与应用能力的考查,注意物质性质的应用,题目难度不大.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | FeS+浓HNO3 | B. | Cu+浓HNO3 | C. | FeO+HNO3 | D. | Fe2O3+HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验 方案 | 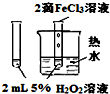 | 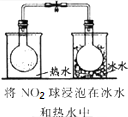 | 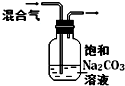 | 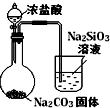 |
| 实验 目的 | 验证FeCl3对H2O2分解反应有催化作用 | 探究温度对平衡2NO2→N2O4的影响 | 除去CO2气体中混有的SO2 | 比较HCl、H2CO3和H2SiO3的酸性强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 可简写为
可简写为 .现有某化合物w的分子结构可表示为
.现有某化合物w的分子结构可表示为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
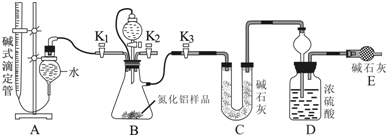
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚有一定毒性,不能用作消毒剂和防腐剂 | |
| B. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| C. | 乙醇和乙酸都是常用调味品的主要成分 | |
| D. | 油脂是人体需要的重要的营养成分,属于天然高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
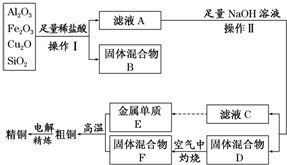
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com