
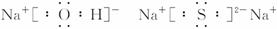
在上述转化关系中,已知B、D都是淡黄色固体,且A与D可反应生成离子化合物I,B与I的相对分子质量相同。请完成下列问题:
(1)写出下列物质的化学式:A___________,F___________,H___________。
(2)写出C的电子式:___________,I的电子式:___________。
(3)写出B→C、E→F的化学反应方程式:_________________________________,
____________________________________________。
(4)写出I与G的稀溶液反应的离子方程式:_________________________________。
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
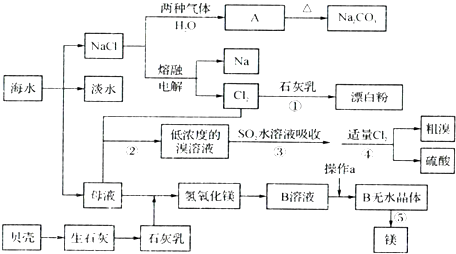
查看答案和解析>>
科目:高中化学 来源: 题型:
尿素[CO(NH2)2]是首个由无机物人工合成的有机物。工业上合成尿素的反应如下:
2NH3(g)+CO2(g) ![]() CO(NH2)2(l) + H2O (l) ΔH < 0 。回答下列问题:
CO(NH2)2(l) + H2O (l) ΔH < 0 。回答下列问题:
(1) 已知工业上合成尿素分两步进行,相关反应如下:
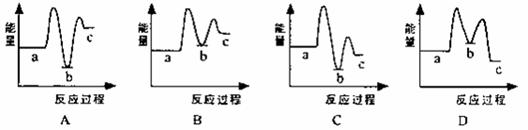
反应Ⅰ:2NH3(g)+CO2(g) ![]() NH2COONH4(s) ΔH1 < 0
NH2COONH4(s) ΔH1 < 0
反应Ⅱ:NH2COONH4(s) ![]() CO(NH2)2(l)+ H2O (l) ΔH 2> 0
CO(NH2)2(l)+ H2O (l) ΔH 2> 0
下列示意图中[a表示2NH3(g)+CO2(g),b表示NH3COONH4(s),c表示CO(NH2)2(l)+H2O(l)],能正确表示尿素合成过程中能量变化曲线是(填序号) ▲ 。
(2)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如下图所示。
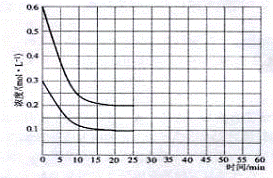
①在上述条件下,从反应开始至20min时,二氧化碳的平均反应速率为 ▲ 。
②为提高尿素的产率,下列可以采取的措施有 ▲ 。
A.缩小反应容器的容积
B.升高温度
C.平衡体系中及时分离出CO(NH2)2
D.使用合适的催化剂
③该反应的平衡常数表达式K= ▲ ;若升高体系的温度,容器中NH3的体积分数将
▲ (填“增加”、“减小”或“不变”)。
④若保持平衡的温度和体积不变,25min时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在上图中画出25~50min内氨气的浓度变化曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
尿素[CO(NH2)2]是首个由无机物人工合成的有机物。工业上合成尿素的反应如下:
![]() 。回答下列问题:
。回答下列问题:
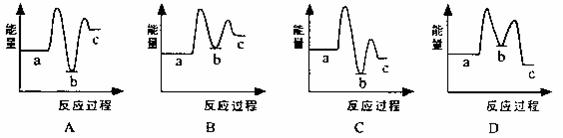
(1)已知工业上合成尿素分两步进行,相关反应如下:
![]()
下列示意图中[a表示2NH3(g)+CO2(g),b表示NH2COONH4(s),c表示CO(NH2)2(l)+H2O(l)],能正确表示尿素合成过程中能量变化曲线是(填序号) 。
 (2)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如下图所示。
(2)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如下图所示。
①在上述条件下,从反应开始至20min时,二氧化碳的平均反应速率为 。
②为提高尿素的产率,下列可以采取的措施有 。
A.缩小反应容器的容积 B.升高温度
C.平衡体系中及时分离出CO(NH2)2 D.使用合适的催化剂
③该反应的平衡常数表达式K= ;若升高体系的温度,容器中NH3的体积分数将 (填“增加”、“减小”或“不变”)。
④若保持平衡的温度和压强不变,再向容器中充入3mol的氨气,则此时v正 v逆(填“>”“=”或“<”),判断理由 。
⑤若保持平衡的温度和体积不变,25min时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在上图中画出25~50min内氨气的浓度变化曲线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com