
【题目】表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.试回答下列问题: 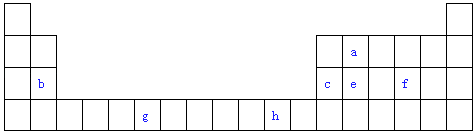
(1)写出元素g的基态原子电子排布式 .
(2)f在空气中燃烧产物的分子构型为 , 中心原子的杂化形式为 , 该分子是(选填“极性”、“非极性”)分子.
(3)由a原子跟e原子以1:1相互交替结合而形成的晶体,晶型与晶体e相同.两者相比熔点更高的是(填化学式),试从结构角度加以解释 .
(4)c单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示. 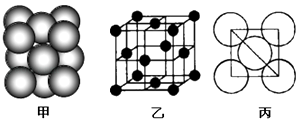
若已知c的原子半径为d厘米,NA代表阿伏伽德罗常数,c的相对原子质量为M,请回答:
①晶胞中c原子的配位数为 , 表示原子空间占有率的代数式为 .
②该晶体的密度为g/cm3(用含有关字母的代数式表示),b、h中,与c单质晶体中原子的堆积方式相同的是(填元素符号).
【答案】
(1)[Ar]3d54s1或1s22s22p63s23p63d54s1
(2)角型(或V字型);sp2杂化;极性分子
(3)SiC;二者同为原子晶体,键长:C﹣Si键<Si﹣Si键,C﹣Si键更牢固
(4)12;![]() ;
;![]() ;Cu
;Cu
【解析】解:(1)g为Cr元素,为24号元素,原子核外有24个电子,所以核外电子排布式为:[Ar]3d54s1或1s22s22p63s23p63d54s1 , 所以答案是:[Ar]3d54s1或1s22s22p63s23p63d54s1;(2)S元素,在空气中燃烧生成SO2 , S有1对孤对电子,存在S=O键,价层电子对个数=σ键个数+孤电子对个数,SO2的价层电子对个数=2+ ![]() (6﹣2×2)=3,S原子采取sp2杂化,为角型(或V字型),正负电荷中心不重合,为极性分子,
(6﹣2×2)=3,S原子采取sp2杂化,为角型(或V字型),正负电荷中心不重合,为极性分子,
所以答案是:角型(或V字型),sp2杂化,极性分子;(3)由C原子跟Si原子以1:1相互交替结合而形成的SiC 晶体,晶型与晶体Si相同.均为原子晶体,但Si﹣C键键长<Si﹣Si键长,则Si﹣C键能大,C﹣Si键更牢固,SiC的熔点高,
所以答案是:SiC;二者同为原子晶体,键长:C﹣Si键<Si﹣Si键,C﹣Si键更牢固;(4)①根据图片知,Al单质为面心立方最密堆积,Al原子配位数=3× ![]() ×8=12,铝 的原子半径为d厘米,晶胞的边长为4dcm×
×8=12,铝 的原子半径为d厘米,晶胞的边长为4dcm× ![]() =2
=2 ![]() dcm,每个铝晶胞中含有4个原子,则铝原子总体积为4×
dcm,每个铝晶胞中含有4个原子,则铝原子总体积为4× ![]() πd3cm3 , 晶胞体积为(2
πd3cm3 , 晶胞体积为(2 ![]() dcm)3 , 故空间利用率为
dcm)3 , 故空间利用率为 ![]() =
= ![]() ,
,
所以答案是: ![]() ;②铝原子个数=8×
;②铝原子个数=8× ![]() +6×
+6× ![]() =4,相对原子质量为M,故晶胞的质量=4×
=4,相对原子质量为M,故晶胞的质量=4× ![]() g,每个铝晶胞中含有4个原子,正方形对角线长度为4d cm,故立方体的棱长为:
g,每个铝晶胞中含有4个原子,正方形对角线长度为4d cm,故立方体的棱长为: ![]() ×4dcm=2
×4dcm=2 ![]() d cm,晶胞体积为(2
d cm,晶胞体积为(2 ![]() dcm)3=16
dcm)3=16 ![]() d3cm3 , 故晶体的密度ρ=
d3cm3 , 故晶体的密度ρ= ![]() =
= ![]() =
= ![]() ,立方最密堆积,属于镁、锌、钛型,面心立方最密堆积(Cu型),所以与c单质晶体中原子的堆积方式相同的是Cu,
,立方最密堆积,属于镁、锌、钛型,面心立方最密堆积(Cu型),所以与c单质晶体中原子的堆积方式相同的是Cu,
所以答案是: ![]() ;Cu.
;Cu.


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】某次酸雨的分析数据如下:c (NH ![]() )=2×10﹣5mol/L、c(Cl﹣)=6×10﹣5mol/L、c (Na+)=1.9×10﹣5mol/L、c (NO
)=2×10﹣5mol/L、c(Cl﹣)=6×10﹣5mol/L、c (Na+)=1.9×10﹣5mol/L、c (NO ![]() )=2.3×10﹣5mol/L、c (SO
)=2.3×10﹣5mol/L、c (SO ![]() )=2.8×10﹣5mol/L,则此酸雨的pH约为( )
)=2.8×10﹣5mol/L,则此酸雨的pH约为( )
A.3
B.4
C.5
D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成如下实验:
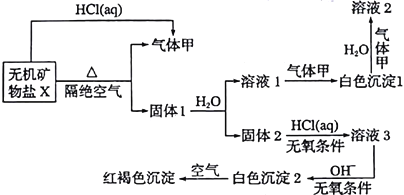
另取21.6gX在惰性气流中加热至完全分解,得到12.8g固体1和0.2mol气体甲。
(1)画出白色沉淀1中金属元素的原子结构示意图_____________,写出气体甲的电子式_______。
(2)X的化学式是______________,在惰性气流中加热X至完全分解的化学反应方程式为______________________________________。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是_______(用化学反应方程式表示)。
(4)一定条件下,气体甲鱼固体1中的某种成分可能发生氧化还原反应,写出一个有气体生成的可能的化学反应方程式______________________________,并设计实验方案验证该反应的产物___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向X的溶液中,加入Y试剂,产生的沉淀或气体如图所示与所述情形相符的是( )
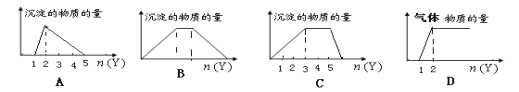
A. 向HCl和AlCl3的混合液中滴加NaOH
B.向NaOH和Ca(OH)2的混合液中通入CO2
C.向NH4Al(SO4)2溶液中滴加NaOH
D.向NaOH和Na2CO3的混合液中滴加稀HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示:
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:① 2Fe3++H2O2 == 2Fe2++O2↑+2H+,② H2O2+2Fe2++2H+ == 2H2O+2Fe3+。反应过程中能量变化如下图所示。下列说法错误的是
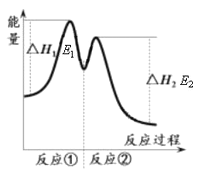
A. Fe3+的作用是增大过氧化氢的分解速率
B. 反应①是吸热反应、反应②是放热反应
C. 反应2H2O2(aq) == 2H2O(l)+O2(g)的ΔH=E1-E2<0
D. 0~6 min的平均反应速率:v(H2O2)=3.33×10-2 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铝是两种重要的金属,它们的单质及其化合物有着各自的性质。
(1)将已配制好的溶液滴入沸水中并煮沸一段时间,可得到红褐色液体,该反应的离子方程式为:________________,此液体具有的性质是_________
a.光束通过该液体时形成光亮的“通路”
b.向该液体中加入AgNO3溶液,无沉淀产生
c.该液体能发生电泳现象,阴极附近颜色变深
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(2)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeC13溶液作为“腐蚀液”,请写出该反应的化学方程式_______________________________。
(3)某氧化铝样品中含有氧化铁、氧化亚铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案,请回答下列问题:
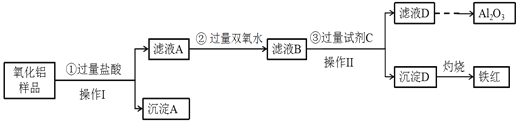
①操作I的名称是_________,该操作用到的玻璃棒的作用 ___________________ 。
②沉淀A的成分是__________(填化学式);验证滤液A中存在Fe3+的具体操作和现象为: _______________________________________________________________。
③用离子方程式说明步骤②中双氧水的作用:
______________________________________________________________。
④滤液D焰色反应呈黄色,试剂C是 ______________(填化学式);
步骤③中铝元素转化的离子方程式 : ___________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,还原剂与还原产物的物质的量之比为
A. 1:8 B. 8:1 C. 1:5 D. 5:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com