
【题目】下列有关电解质溶液的说法正确的是
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中![]() 减小
减小
B.在0.1mol·L-1的稀硫酸加水稀释的过程中,c(H+):c(SO42-)始终为2:1
C.向盐酸中加入氨水至中性,溶液中
D.在含0.1mol NaHSO4溶液中:c(H+)=c(SO42-)+c(OH-)
科目:高中化学 来源: 题型:
【题目】材料是人类赖以生存和发展的重要物质基础,下列说法正确的是( )
A.铜和铁都是热和电的良导体
B.棉纱和蚕丝都属于合成纤维
C.玻璃和光导纤维都是硅酸盐材料
D.聚乙烯和聚氯乙烯都可制成食品保鲜膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。
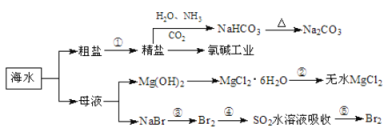
下列有关说法正确的是
A.在第③、④、⑤步骤中,溴元素均被氧化
B.制取NaHCO3的反应是利用其在此反应所涉及物质中溶解度最小
C.用澄清的石灰水可鉴别NaHCO3和Na2CO3
D.工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)根据如图所示情况,判断下列说法中正确的是 。
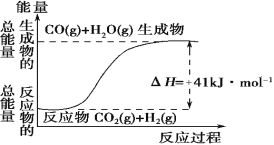
A.其热化学方程式为:CO(g) + H2O(g)=CO2(g) + H2(g) ΔH=41 kJ·mol-1
B.该反应为吸热反应
C.该反应为放热反应
D.若当H2O为液态时反应热为ΔH2,则ΔH2>ΔH
(2)25℃、101 kPa下,已知1g氢气完全燃烧生成液态水时放出142.9 kJ的热量,表示氢气燃烧热的热化学方程式是 。
(3)已知反应:N2(g) + O2 (g) = 2NO(g) △H1
2H2(g) + O2(g) = 2H2O(g) △H2
N2(g) + 3H2(g) = 2NH3(g) △H3
利用上述三个反应,计算4NH3(g) + 5O2(g) = 4NO(g) + 6H2O(g) △H4 的反应焓变为 (用含△H1、△H2、△H3的式子表示)。
(4)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
①大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为 。
②已知反应2HI(g)![]() H2(g) + I2(g)的△H= + 11kJmol﹣1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为 kJ。
H2(g) + I2(g)的△H= + 11kJmol﹣1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为 kJ。
③Bodensteins研究了下列反应:2HI(g)![]() H2(g) + I2(g)
H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
根据上述实验结果,该反应的平衡常数K的计算式为: 。上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为 (以K和k正表示)。若k正=0.0027min﹣1,在t=40min时,v正= min﹣1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是几种常见的化学电源示意图,有关说法不正确的是

A. 上述电池分别属于一次电池、二次电池和燃料电池
B. 干电池在长时间使用后,锌筒被破坏
C. 铅蓄电池工作过程中,每通过2mol电子,负极质量减轻207g
D. 氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A.18 g D2O和18 g H2O中含有的质子数均为10NA
B.14 g CO、C2H4混合气体与11.2 L N2所含有的分子数都是0.5NA
C.过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA
D.密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃与溴的四氯化碳溶液反应生成CHBr2CBr2CH2CH3 , 则与该烃不同类别的同分异构体是( )
A.CH≡CCH2CH3
B.CH3C≡CCH3
C.CH3CH2CH2CH3
D.CH2=CHCH=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)发展洁净煤技术、利用CO2制备清洁能源等都是实现减碳排放的重要途径。
(1)将煤转化成水煤气的反应:C(s)+H2O(g)![]() CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中加入催化剂(其他条件保持不变),此反应的△H________(填“增大”、“减小”或“不变”),判断的理由是________。
CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中加入催化剂(其他条件保持不变),此反应的△H________(填“增大”、“减小”或“不变”),判断的理由是________。
(2)CO2制备甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH=-49.0kJ·mol-1,在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如右图所示。
CH3OH(g)+H2O(g)ΔH=-49.0kJ·mol-1,在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如右图所示。
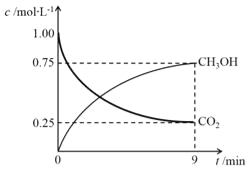
①该反应化学平衡常数K的表达式是________。
②0~9min时间内,该反应的平均反应速率ν(H2)=________。
③在相同条件下,密闭容器的体积缩小至0.5L时,此反应达平衡时放出的热量(Q)可能是________(填字母序号)kJ。
a.0<Q<29.5
B.29.5<Q<36.75
C.36.75<Q<49
D.49<Q<98
④在一定条件下,体系中CO2的平衡转化率(α)与L和X的关系如右图所示,L和X分别表示温度或压强。
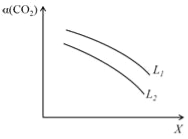
X表示的物理量是。判断L1与L2的大小关系。
(3)科学家用氮化镓材料与铜组装如右图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.
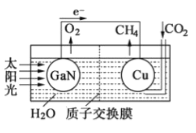
写出铜电极表面的电极反应式,为提高该人工光合系统的工作效率,可向装置中加入少量(选填“盐酸”或“硫酸”).
(4)利用CO2和NH3为原料也合成尿素,在合成塔中的主要反应可表示如下:
反应①:2NH3(g)+CO2(g)=NH2CO2NH4(s)△H1=__________________
反应②:NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H2=+72.49kJ·mol-1
总反应:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g)△H=-86.98kJ·mol-1;
则反应①的△H1=_______________。
(5)现将amol铁和bmol铜的混合物与含有cmolHNO3的稀溶液充分反应,设还原产物为NO。下列结论不正确的是(填序号)
A.若剩余金属0.5amol,则氧化产物为一种或二种
B.若只有一种氧化产物,则3c=8a
C.若有二种氧化产物,被还原的硝酸物质的量为0.25cmol
D.若有三种氧化产物,被还原的硝酸物质的量为0.25cmol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com