
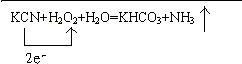 .
.  名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,氧化产物是K2SO3,氧化剂与还原剂的物质的量之比为2:1,若反应中消耗了0.6molS,则反应中转移的电子为0.8mol.
,氧化产物是K2SO3,氧化剂与还原剂的物质的量之比为2:1,若反应中消耗了0.6molS,则反应中转移的电子为0.8mol.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
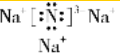 ,该化合物是由离子键形成的.
,该化合物是由离子键形成的.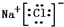 、
、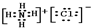 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、纯碱、石膏、铁红 | B. | 醋酸、烧碱、纯碱、生石灰 | ||
| C. | 碳酸、熟石膏、小苏打、三氧化硫 | D. | 氯化氢、苛性钠、氯化钠、石灰石 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据物质能否导电将物质分为电解质和非电解质 | |
| B. | 根据反应中的热效应将化学反应分为放热反应和吸热反应 | |
| C. | 根据溶液导电性强弱将电解质分为强电解质和弱非电解质 | |
| D. | 根据元素的化合价的高低将化学反应分为氧化还原反应和非氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | A(g)+B(g)→C(g)+D(l)是放热反应 | |
| B. | A(g)+B(g)→C(g)+D(l)是吸热反应 | |
| C. | C(g)+D(l)→A(g)+B(g)是放热反应 | |
| D. | C(g)+D(l)具有的能量大于A(g)+B(g)具有的能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com