

| A、实验①、③反应制得的物质均为纯净物 |
| B、实验②、③均未发生氧化还原反应 |
| C、实验②、③均为放热反应 |
| D、实验①、②所涉及的物质均为电解质 |


科目:高中化学 来源: 题型:
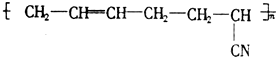 具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是( )
具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是( )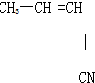
| A、③⑥ | B、②③ | C、①③ | D、④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、镁在空气中或纯净氧气中燃烧的产物都只有MgO |
| B、钠在敞口容器中存放或在空气中燃烧的产物都是Na2O2 |
| C、将四氧化三铁溶解于过量的硝酸,所得溶液中含有Fe3+、Fe2+ |
| D、偏铝酸钠和少量的二氧化碳反应一定得到Al(OH)3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④⑤ | B、①③④⑥ |
| C、①②⑤⑥ | D、①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| IV | a>x≥c | 无明显变化 | 有Cl2 |
| V | c>x≥b | 无明显变化 | 无Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数 | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
| A、25℃,等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3 四种溶液中,碱性最强的是Na2CO3 |
| B、将0.1 mol?L-1的醋酸加水不断稀释,所有离子浓度均减小 |
| C、少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
| D、少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-=CO32-+2HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com