
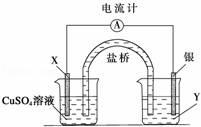
根据下列氧化还原反应2FeCl3+Cu═2FeCl2+CuCl2设计一个原电池:
请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 ;
(2)银电极为电池的 极,发生的电极反应为 ;
X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极(填具体电极如Ag”).
考点: 设计原电池;原电池和电解池的工作原理.
专题: 电化学专题.
分析: 该反应中,Cu元素化合价由0价变为+2价、Fe元素化合价由+3价变为+2价,所以Cu作负极,不如Cu活泼的金属或导电的非金属作正极,FeCl3溶液为电解质溶液,以此解答该题.
解答: 解:(1)铜氧化,应为原电池负极,则正极为较铜更不活泼的金属,由装置图可知,银为正极,则X为负极,应为铜,电解质溶液Y是FeCl3,
故答案为:Cu;FeCl3;
(2)银为正极,发生还原反应,电极方程式为2Fe3++2e﹣=2Fe2+,X为正极,电极方程式为Cu﹣2e﹣=Cu2+,
故答案为:正;2Fe3++2e﹣=2Fe2+;Cu﹣2e﹣=Cu2+;
(3)原电池工作时,电子从负极经导线流向正极,即从铜与流向银,故答案为:Cu;Ag.
点评: 本题考查了原电池设计,根据方程式中得失电子的物质判断负极极电解质,方程式中失电子化合价升高的金属单质作负极,得电子化合价降低的化合物为其电解质.


科目:高中化学 来源: 题型:
现有一定体积的HCl气体,将其溶于100mL稀硫酸中,假设溶液的体积不变,向混合溶液中加入4mol•L﹣1的NaOH溶液10mL恰好呈中性.继续向所得中性溶液中滴入过量的Ba(OH)2溶液,所得沉淀质量为2.33g.
(1)生成沉淀的化学方程式为: .
(2)硫酸的物质的量浓度:c(H2SO4)= .
(3)该HCl气体在标准状况下的体积为 mL.
(4)若向该混酸溶液(仍为100mL)中加入Na2CO3•10H2O晶体,直到不再产生气体时为止,消耗Na2CO3•10H2O晶体的质量为 g.
查看答案和解析>>
科目:高中化学 来源: 题型:
规范书写是我们学习中必须遵循的原则,小明在元素周期表中查找到如图所示的一格后,明白了不能把一氧化碳写成“Co”的原因.
(1)“Co”表示 元素(填名称);
(2)“CO”是由 两种元素(填名称)组成的 (填“单质”或“化合物”).

查看答案和解析>>
科目:高中化学 来源: 题型:
烧杯A中盛放0.1mol•L﹣1的H2SO4溶液,烧杯B中盛放0.1mol•L﹣1的CuCl2溶液(两种溶液均足量),装置如图所示,下列说法正确的是()
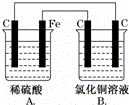
A. A为电解池,B为原电池
B. Fe电极发生还原反应
C. 当A烧杯中产生0.1 mol气体,B烧杯中产生气体也为0.1mol
D. 一段时间后,B烧杯中溶液的浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为()
A. 1:2:3 B. 3:2:1 C. 6:3:1 D. 6:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物大多易挥发,因此许多有机物保存时为避免挥发损失,可加一层水即“水封”,下列有机物可以用“水封法”保存的是()
A. 乙醇 B. 氯仿 C. 乙醛 D. 乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是()
A. 乙酸与碳酸钠溶液反应:2H++CO32﹣═CO2↑+H2O
B. 醋酸溶液与新制氢氧化铜反应:2CH3COOH+Cu(OH)2→Cu2++2CH3COO﹣+2H2O
C. 苯酚钠溶液中通入少量二氧化碳:2C6H5O﹣+CO2+H2O 2C6H5OH+CO32﹣
2C6H5OH+CO32﹣
D. 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH﹣ CO32﹣+2NH4++4Ag↓+6NH3+2H2O
CO32﹣+2NH4++4Ag↓+6NH3+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
中科院化学所研制的晶体材料﹣﹣纳米四氧化三铁,在核磁共振造影及医药上有广泛用途其生产过程的部分流程如下:FeCl3•6H2O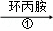 FeOOH
FeOOH 纳米四氧化三铁,下列有关叙述不合理的是()
纳米四氧化三铁,下列有关叙述不合理的是()
A. 纳米四氧化三铁可分散在水中,它与FeCl3溶液的分散质直径相当
B. 纳米四氧化三铁具有磁性,可作为药物载体用于治疗疾病
C. 在反应①中环丙胺的作用可能是促进氯化铁水解
D. 反应②的化学方程式是6FeOOH+CO=2Fe3O4+3H2O+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解.
(2)把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是 .
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com