
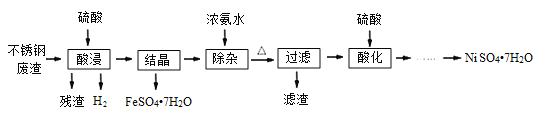
【题目】硫酸镍是电镀工业必不可少的化工原料。从不锈钢废渣(主要含Fe42.35%、Cr9.67%、Ni5.1%、C4.7%、Si3.39%等)中制取硫酸镍晶体的工艺流程如图:
 已知:①Cr3+与氨水反应时有少量Cr3+生成[Cr(NH3)6]3+,但加热时该络合物易分解。Ni2+与氨水反应生成[Ni(NH3)6]2+,该络合物加热时稳定,用硫酸酸化时生成相应的硫酸盐。
已知:①Cr3+与氨水反应时有少量Cr3+生成[Cr(NH3)6]3+,但加热时该络合物易分解。Ni2+与氨水反应生成[Ni(NH3)6]2+,该络合物加热时稳定,用硫酸酸化时生成相应的硫酸盐。
②Na2CrO4溶液中加酸调节pH为3.5时,CrO42-转化为Cr2O72-。
③相关物质在不同温度时溶解度如下表:
温度 溶解度/g 物质 | 20℃ | 30℃ | 40℃ | 60℃ | 80℃ | 90℃ |
Na2SO4 | 19.5 | 40.8 | 48.8 | 45.3 | 43.7 | 42.7 |
Na2Cr2O7 | 183 | 198 | 215 | 269 | 376 | 405 |
(1)“酸浸”后得到的溶液中主要含有FeSO4、NiSO4、Cr2(SO4)3,生成NiSO4的化学方程式为___。“酸浸”时需控制温度为90℃左右,可以采用的加热方式是___。
(2)“过滤”前,适当加热的目的是___。
(3)对“过滤”所得的滤渣进行洗涤,检验滤渣已洗涤干净的方法是___。
(4)“过滤”时产生的滤渣可用于制备Na2Cr2O7晶体。
①滤渣经干燥后与Na2CO3混合在空气中煅烧生成Na2CrO4和CO2,此反应的化学方程式为___。
②请补充完整上述煅烧后混合物制备Na2Cr2O7晶体(橙红色)的实验方案:水浸,过滤,___,烘干得Na2Cr2O7晶体(必须使用的试剂有:硫酸,蒸馏水)。
【答案】Ni+H2SO4=NiSO4+H2↑ 90℃水浴加热 使[Cr(NH3)6]3+分解生成Cr(OH)3沉淀 取少量最后一次洗涤液于试管中,加入BaCl2溶液,若无沉淀生成,则已洗净 4Cr(OH)3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2+6H2O 向滤液中加入硫酸调节pH至3.5,将溶液加热到90℃(以上)蒸发结晶,至有少量橙红色晶体析出时趁热过滤,滤液降温至40℃结晶,过滤,用蒸馏水洗涤,干燥,得Na2Cr2O7晶体
4Na2CrO4+4CO2+6H2O 向滤液中加入硫酸调节pH至3.5,将溶液加热到90℃(以上)蒸发结晶,至有少量橙红色晶体析出时趁热过滤,滤液降温至40℃结晶,过滤,用蒸馏水洗涤,干燥,得Na2Cr2O7晶体
【解析】
由工艺流程图分析可知,从不锈钢废渣(主要含Fe 42.35%、Cr 9.67%、Ni 5.1%、C 4.7%、Si 3.39%等),由实验流程可知,硫酸溶解分离出残渣为Si、C,“酸浸”后得到的溶液中主要含有FeSO4、NiSO4、Cr2(SO4)3,然后结晶分离出绿矾,结晶信息可知加氨水生成[Cr(NH3)6]3+,但加热时该络合物易分解,而Ni2+与氨水反应生成[Ni(NH3)6]2+,该络合物加热时稳定,过滤分离出[Ni(NH3)6]2+,用硫酸酸化时生成NiSO4,蒸发浓缩、冷却结晶、过滤分离出硫酸镍晶体,以此来解答。
根据上述分析可知:
(1)生成NiSO4的化学方程式为Ni+H2SO4═NiSO4+H2↑,“酸浸”时需控制温度为90℃左右,可以采用的加热方式是90℃水浴加热,故答案为:Ni+H2SO4═NiSO4+H2↑;90℃水浴加热;
(2)“过滤”前,适当加热的目的是使[Cr(NH3)6]3+分解生成Cr(OH)3沉淀,故答案为:使[Cr(NH3)6]3+分解生成Cr(OH)3沉淀;
(3)对“过滤”所得的滤渣进行洗涤,检验滤渣已洗涤干净的方法是检验是否含有硫酸根离子,即取少量最后一次洗涤过滤液于试管中,先用盐酸酸化,再加入BaCl2溶液,若无沉淀生成,则已洗净,故答案为:取少量最后一次洗涤过滤液于试管中,先用盐酸酸化,再加入BaCl2溶液,若无沉淀生成,则已洗净;
(4)①滤渣经干燥后与Na2CO3混合在空气中煅烧生成Na2CrO4和CO2,此反应的化学方程式为4Cr(OH)3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2+6H2O,故答案为:4Cr(OH)3+4Na2CO3+3O2
4Na2CrO4+4CO2+6H2O,故答案为:4Cr(OH)3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2+6H2O;
4Na2CrO4+4CO2+6H2O;
②根据题干信息可知制备Na2Cr2O7晶体(橙红色)的实验方案:水浸,过滤,向滤液中加入硫酸调节pH至3.5,将溶液加热到90℃(以上)蒸发结晶,有大量无色晶体析出,至有少量橙红色晶体析出时趁热过滤,滤液降温至40℃结晶,过滤,用蒸馏水洗涤,干燥,得Na2Cr2O7晶体。


科目:高中化学 来源: 题型:
【题目】有下列几组物质,请将序号填入下列空格内:
A C60和石墨 B 126C和136C C 冰醋酸和乙酸 D CH3CHO与![]() E 甲烷和十二烷 F 乙醇和乙二醇
E 甲烷和十二烷 F 乙醇和乙二醇
①互为同位素的是_________;
②互为同系物的是___________;
③互为同分异构体的是________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用Ca与H2反应制取氢化钙(CaH2)。下列实验装置和原理不能达到实验目的的是( )
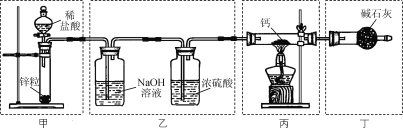
A. 装置甲制取H2B. 装置乙净化干燥H2
C. 装置丙制取CaH2D. 装置丁吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药麻黄成分中含有生物碱、黄酮、鞣质、挥发油、有机酚、多糖等许多成分,其中一种有机酚的结构简式如图。下列说法正确的是( )
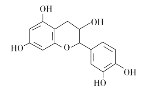
A.分子中所有碳原子可以处于同一平面
B.分子中含有2个手性原子
C.1mol该有机物跟足量浓溴水反应,最多消耗5molBr2
D.1mol该有机物与NaOH溶液反应最多消耗5molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物(G)的合成路线如图:

已知:CH3(CH2)4Br![]() CH3(CH2)3CH2MgBr
CH3(CH2)3CH2MgBr
(1)G中所含的含氧官能团有___、___(写官能团名称)。
(2)C→D的反应类型是___;在空气中久置,A可由白色转变为橙黄色,其原因是___。
(3)写出符合下列条件的A的一种同分异构体的结构简式:___(只写一种)。
①能发生银镜反应,与FeCl3溶液能发生显色反应;②除苯环外,含有3种不同的官能团;③该分子核磁共振氢谱有5种不同的峰,且峰值比为1∶1∶2∶2∶2。
(4)写出以苯、乙醇、二甲基甲酰胺为原料制备苯丙酮(![]() )的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。___。
)的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,物质之间通过一步反应无法实现如图所示转化的是( )
物质转化关系 | a | b | c | d | |
A |
| FeCl2 | FeCl3 | Fe | CuCl2 |
B | SO2 | SO3 | S | H2SO4 | |
C | CH2ClCH2Cl | CH≡CH | CH2OHCH2OH | CH2=CH2 | |
D | Al2O3 | NaAlO2 | Al | Al(OH)3 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究X(仅含三种元素)的组成和热稳定性,设计并完成如下实验:
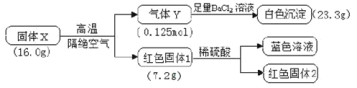
气体Y不能使品红溶液褪色,红色固体1是一种纯净物,请回答:
(1)X除了含有Cu元素之外,还有___元素(填元素符号)。
(2)该流程中X高温分解的化学方程式为____。
(3)写出气体Y通入BaCl2溶液发生反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫在自然界的循环过程如图所示。下列说法中,不正确的是
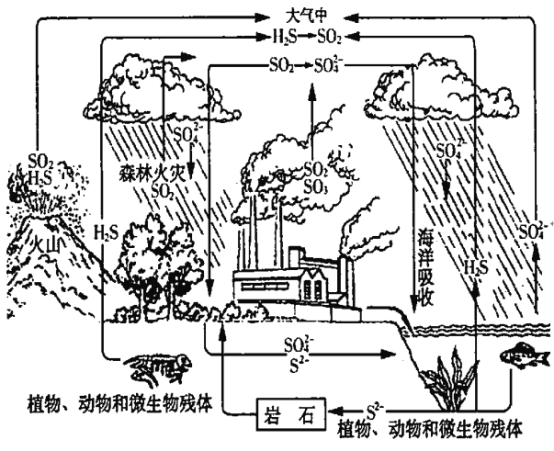
A. 火山喷发、森林火灾会产生SO2
B. 氢、氧两种元素没有参与硫的循环
C. 工厂产生的烟气应经脱硫处理后再排放
D. 硫在自然界的循环过程中,涉及了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
(1)实验室用金属铜和稀硝酸制取NO的离子方程式为:__________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
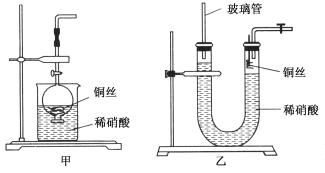
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)。
A.铁B.铝C.铂D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是____________________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。长玻璃管的作用是______________________________________________。
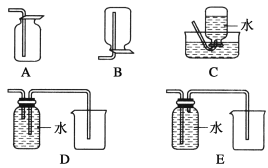
(4)以下收集NO气体的装置,合理的是________(填选项代号)。
(5)假设实验中12.8gCu全部溶解,需要通入标况下________LO2才能使NO全部溶于水。
(6)用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是________(填“甲”、“乙”、“丙”或“丁”),理由是____________________________。
甲:铜+浓硝酸→硝酸铜
乙:铜+稀硝酸→硝酸铜
丙:铜+氯气→氯化铜;氯化铜+硝酸→硝酸铜
丁:铜+空气→氧化铜;氧化铜+硝酸→硝酸铜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com