
| A. | 氢氧化铝可用于治疗胃酸过多 | |
| B. | ClO2用于饮用水消毒 | |
| C. | 水玻璃浸泡过的木材既能防腐又能耐火 | |
| D. | Si用于制造光导纤维 |
科目:高中化学 来源: 题型:选择题
| A. | 将pH=6的H2SO4 稀释1000倍后,c(H+)=2 c(SO42-) | |
| B. | 0.1 mol L-1的 Na2CO3溶液中:c(OH- )=c(HCO3- )+c(H+)+c(H2CO3) | |
| C. | 浓度均为0.1 mol L-1的 NaClO 溶液和 CH3COONa 溶液中,c(ClO-)<c(CH3COO-) | |
| D. | 浓度分别为0.1 mol L-1和0.01 mol L-1的CH3COOH溶液中:c(CH3COO-)前者是后者的10倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2009年4月22日是第40个世界地球日,今年世界地球日的主题是“绿色世纪”.
2009年4月22日是第40个世界地球日,今年世界地球日的主题是“绿色世纪”.| A. | 加强海底可燃冰的探测与开发研究 | |
| B. | 积极推广风能、水能和太阳能发电 | |
| C. | 在生产、流通、消费等领域中实行“减量化、再利用、资源化” | |
| D. | 将高能耗、高污染的企业迁至偏僻的农村地区,提高农民收入 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>R>Z | B. | 最高价氧化物对应水化物酸性:R>W | ||
| C. | X与W形成的是离子化合物 | D. | 气态氢化物的热稳定性:Y>R |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨既是实验室中常用试剂,也是工业上重要原料.
氨既是实验室中常用试剂,也是工业上重要原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素非金属性由强到弱的顺序:Y、X、W | |
| B. | W的简单气态氢化物比Y的简单气态氢化物稳定 | |
| C. | 原子半径由大到小的顺序:Z、Y、X、W | |
| D. | WX与ZX中的化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
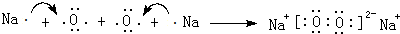 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2O2═2H2O+O2↑ | B. | HCl+NaOH═H2O+NaCl | ||
| C. | Fe+CuCl2═FeCl2+Cu | D. | 2Cu+O2═2CuO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com