
【题目】氮、磷、砷(As)等VA族元素的化合物在研究和生产中有许多重要用途。
(1)写出基态As原子的核外电子排布式___________________。
(2)NH3、PH3、AsH3熔沸点由高到低的顺序为______。
(3)水合肼(N2H4·H2O)又名水合联氨,是一种重要的化工试剂。利用尿素法生产水合肼的原理为:CO(NH2)2+ 2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCL,该反应中所涉及的第二周期元素第一电离能大小顺序是________。晶体N2H4·H2O中各种微粒间的作用力不涉及__(填字母)。
a:离子键 b.共价键 c.金属键 d.氢键 e.范德华力
(4)NO3-的VSEPR模型是____,H3AsO3分子中As的杂化方式为____。
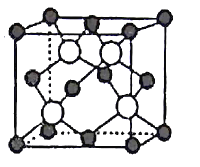
(5)GaAs以第三代半导体著称,性能比硅更优良,广泛用于电子计算机、人造卫星等尖端技术。它的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。GaAs为___ 晶体,晶胞结构与NaCl晶胞____(填“相同”或“不同”)。Ga和As的摩尔质量分别为MGag·mol-l和MAsg·mol-l,原子半径分别为rGapm和rAspm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为___ 。
【答案】 1s22s22p63d104s24p3或[Ar]3d104s24p3 NH3>AsH3>PH3 N>O>C ac 平面三角形 sp2 原子 相同 ![]()
【解析】(1)As为33号元素,基态原子核外电子排布式1s22s22p63d104s24p3或[Ar]3d104s24p3;(2)由于NH3分子间存在氢键,故NH3的熔沸点最高,由于AsH3的相对分子质量大于PH3,故AsH3的熔沸点高于PH3,因此熔沸点由高到低的顺序为NH3>AsH3>PH3;(3)反应CO(NH2)2+ 2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl中所涉及的第二周期元素有C、N、O,C、N、O属于同一周期元素且原子序数依次减小,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,所以其第一电离能大小顺序是N>O>C;晶体N2H4·H2O为分子晶体,分子内部存在共价键,与分子间存在氢键和分子间作用力(范德华力),便不涉及离子键和金属键;答案选ac;(4)NO3-中N原子的价层电子对数为![]() =3,则为sp3杂化,没有孤电子对,所以NO3-的VSEPR模型、离子立体构型为平面三角形;根据H3AsO3分子中中心原子As的价层电子对数为
=3,则为sp3杂化,没有孤电子对,所以NO3-的VSEPR模型、离子立体构型为平面三角形;根据H3AsO3分子中中心原子As的价层电子对数为![]() ,所以As原子的杂化方式为sp2杂化;(5)根据GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示,熔点很高,所以GaAs为原子晶体;根据晶胞结构可知晶胞中Ga和As的个数均是4个,晶胞结构与NaCl晶胞相同;晶胞的体积为
,所以As原子的杂化方式为sp2杂化;(5)根据GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示,熔点很高,所以GaAs为原子晶体;根据晶胞结构可知晶胞中Ga和As的个数均是4个,晶胞结构与NaCl晶胞相同;晶胞的体积为![]() ,二者的原子半径分别为rGapm和rAspm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为
,二者的原子半径分别为rGapm和rAspm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为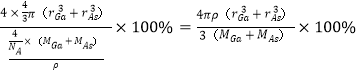 。
。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:
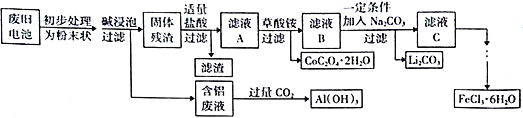
已知:①还原性:Cl->Co2+;
②Fe3+和C2O42-结合生成较稳定的[ Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
(1)废旧电池初步处理为粉末状的目的是________________________________________。
(2)从含铝废液得到Al(OH)3的离子反应方程式为__________________________________。
(3)滤液A中的溶质除HCl、LiCl外还有__________(填化学式)。写出LiCoO2和盐酸反应的化学方程式__________________________________。
(4)滤渣的主要成分为____________________(填化学式)。
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见下表,请补充完整表中问题。
已知:①CoC2O4在空气中加热时的气体产物为CO2
②固体失重率=对应温度下样品失重的质量/样品的初始质量
序号 | 温度范围/℃ | 化学方程式 | 固体失重率 |
Ⅰ | 120-220 | CoC2O4·2H2O | 19.67% |
Ⅱ | 300~350 | _________________________ | 59.02% |
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02mol·L-1的Li2SO4和浓度为0.02 mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为___________mol·L-1
(7)从FeCl3溶液得到FeCl3·6H2O固体的操作关键是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请完成下列物质的分离提纯问题。
Ⅰ.现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,,从而得到纯净的NaNO3溶液。相应的实验过程可用如图表示:

请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X__________,沉淀B________。
(2)证明AgNO3溶液加过量的实验方法是___________。
(3)按此实验方案得到的溶液3中肯定含有_____________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___________,之后若要获得固体NaNO3需要进行的实验操作是______.(填操作名称)。
Ⅱ.某同学欲用CCl4萃取较高浓度的碘水中的碘,操作过程可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mLCC14加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层。
(1)萃取过程正确操作步骤的顺序是:______(填编号字母)。
(2)最后碘的CCl4是通过获得________(填“漏斗上口”或“漏斗下口”)。从含碘的CCl4溶液中提取碘和回收CCl4,还需要经过蒸馏,观察下图所示实验装置指出其错误有____________处。

(3)进行上述蒸馏操作时,最后晶态碘在_________(填仪器名称)里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图1是细胞中3种化合物含量的扇形图,图2是活细胞中元素含量的柱形图,下列叙述不正确的是( )

A. 图2中数量最多的元素是碳元素,这与细胞中含量最多的化合物有关
B. 若图1表示正常细胞,则B化合物具有多样性,其必含的元素为C、H、O、N
C. 若图1表示正常细胞,则A、B化合物共有的元素中含量最多的是图2中的a
D. 若图1表示细胞干重中化合物含量的扇形图,则 A化合物中含量最多的元素为图2中的b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示构成细胞的元素、化合物,a、b、c、d代表不同的小分子物质,A、B、C代表不同的大分子物质,据图分析不正确的是( )

A. 若物质A是动、植物细胞中均含有的储能物质,则A是脂肪
B. 物质b是氨基酸,若某种B分子由n个b分子(平均相对分子质量为m)组成的2条链组成,则该B分子的相对分子质量大约为mn﹣18(n﹣2)
C. 物质c在人体细胞中共有5种,分子中的含氮碱基不同决定了c的种类不同
D. 物质d是性激素,d和胆固醇、维生素D都属于固醇类物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学一选修5:有机化学基础】某课题组以苯为主要原料,采取以下路线合成利胆药——柳胺酚。
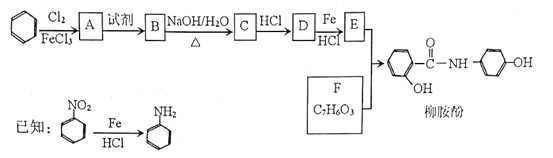
回答下列问题:
(1)F的化学名称____,由E和F生成柳胺酚的反应类型是____。
(2)写出由A生成B反应所需的试剂_____。
(3)写出由B生成C的化学方程式____。
(4)对于柳胺酚,下列说法正确的是____。
a.可发生水解反应 b.不发生硝化反应
c.1 mol柳胺酚最多可以和2molNaOH反应 d.可与溴发生取代反应
(5)写出所有同时符合下列条件的F的同分异构体的结构简式_________。
①苯环上有2种不同化学环境的氢原子;②能发生银镜反应;③能与FeCl3发生显色反应
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )与乙酸制备4-甲氧基乙酰苯胺的合成路线_______________(无机试剂及溶剂任选)。合成路线的书写格式参照如下示例流程图:
)与乙酸制备4-甲氧基乙酰苯胺的合成路线_______________(无机试剂及溶剂任选)。合成路线的书写格式参照如下示例流程图:
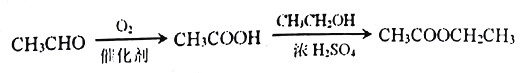
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示细胞内某些有机物的元素组成和功能关系,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ是生物大分子,图中X、Y、Z、P分别为构成生物大分子的基本单位.请回答下列问题:

(1)图中X是________,Ⅰ在植物细胞中主要是指___________。
(2)与Ⅳ相比,Ⅱ特有的元素是_____。
(3)鉴定Ⅳ使用_______试剂,反应呈现______色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一些烷烃的燃烧热如下表:
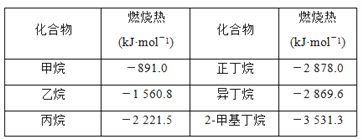
下列说法正确的是( )
A. 正戊烷的燃烧热大约是-3 540 kJ·mol-1
B. 热稳定性:正丁烷>异丁烷
C. 乙烷燃烧的热化学方程式为2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g) ΔH=-1 560.8 kJ·mol-1
D. 相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com