
【题目】处理含铬废水的方法较多
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强。为回收利用,通常采用如下流程处理:

已知: Cr(OH)3―→NaCrO2―→Na2CrO4―→Na2Cr2O7
请回答:
(1)操作Ⅰ的名称为____________,上述操作Ⅰ、Ⅱ、Ⅲ相同,进行该实验操作所需要的主要玻璃仪器除烧杯、漏斗外,还有__________。
(2)滤渣Ⅰ的主要成分为________(写化学式),试剂乙的名称为__________。
(3)加入试剂甲的目的是____________________________________________________。
(4)废水处理流程中生成滤渣Ⅲ的离子方程式为________________________________。
Ⅱ.酸性条件下,六价铬主要以Cr2O![]() 形式存在。工业上用以下方法处理含Cr2O
形式存在。工业上用以下方法处理含Cr2O![]() 的废水:①往废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,还原Cr2O
的废水:①往废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,还原Cr2O![]() ;③经过一段时间,最后有Cr(OH)3和Fe(OH)3沉淀产生过滤回收沉淀,废水达到排放标准。
;③经过一段时间,最后有Cr(OH)3和Fe(OH)3沉淀产生过滤回收沉淀,废水达到排放标准。
(5) 在②步中,电解法除铬的原理是(写出涉及的主要电极反应式和离子方程式)_____________________________________________________________。
(6)已知某含Cr2O![]() 的酸性工业废水中铬元素的含量为104.5 mg·L-1,处理后铬元素最高允许排放浓度为0.5 mg·L-1。处理该废水1 000 m3并达到排放标准至少消耗铁的质量为________kg。
的酸性工业废水中铬元素的含量为104.5 mg·L-1,处理后铬元素最高允许排放浓度为0.5 mg·L-1。处理该废水1 000 m3并达到排放标准至少消耗铁的质量为________kg。
【答案】 过滤 玻璃棒 Cu(OH)2、Fe(OH)3 氨水 将Fe2+氧化成Fe3+ AlO![]() +CO2+2H2O===Al(OH)3↓+HCO
+CO2+2H2O===Al(OH)3↓+HCO![]() Fe-2e-= Fe2+ Cr2O
Fe-2e-= Fe2+ Cr2O![]() +6 Fe2++14H+=== 2Cr3++6Fe3++7H2O 336
+6 Fe2++14H+=== 2Cr3++6Fe3++7H2O 336
【解析】考查化学工艺流程,(1)根据流程图,操作I得到滤渣和滤液,因此操作I为过滤;过滤中所用的玻璃仪器是烧杯、漏斗、玻璃棒;(2)根据流程的目的,以及所含的杂质,加入过量氢氧化钠,发生Cr3++4OH-=CrO2-+2H2O、Al3++4OH-=AlO2-+2H2O、Cu2++2OH-=Cu(OH)2↓、Fe3++3OH-=Fe(OH)3↓,因此滤渣I的成分是Fe(OH)3和Cu(OH)2;因为Cu(OH)2溶于过量的氨水,形成络合物,因此试剂乙为氨水;(3)根据工业废水的成分以及加入试剂甲后的离子,Fe2+转化成Fe3+,因此加入试剂甲的目的是把Fe2+氧化成Fe3+;(4)利用碳酸的酸性强于偏铝酸,发生AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;(5)电解过程中Fe作阳极,电极反应式为Fe-2e-=Fe2+,然后利用Cr2O72-的氧化性,把Fe2+氧化成Fe3+,利用化合价的升降法,进行配平,即离子反应式为:Cr2O +6 Fe2++14H+= 2Cr3++6Fe3++7H2O;(6)根据得失电子数目守恒,n(Cr)×3=n(Fe)×3,即1000×103×(104.5-0.5)×10-3×3/52=n(Fe),解得n(Fe)=6000mol,合336kg。


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】某有色金属研究室对从银锰精矿中提取单质银的方法进行改良创新,从而更高效地实现锰和银的分离。其简易流程如下图。已知:银锰精矿主要成分为MnO2和银单质。
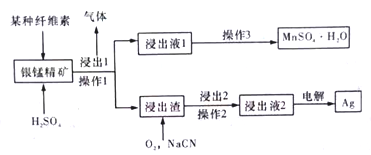

(1)操作1与操作2所对应的分离方法是__________________。
(2)通过对“浸出1”步骤中纤维细度的控制,绘制出一定时间内纤维素-Mn浸出率图象如上图所示,实际生产中应控制细度________mm较为合适,理由是_________。
(3)在“浸出1”步骤中,纤维素会先水解为单糖,请写出该单糖(用分子式表达)与银锰精矿反应的离子方程式:_______________________。
(4)浸出液2的主要成分为[Ag(CN)2]-,使用情性电极电解浸出液2,请写出阴极的电极方程式:________。本流程中可循环使用的物质为_________________。
(5)通过上述流程,浸出液1中通常还含有少量银离子,充分提取银,可对MnSO4·H2O晶体进行洗涤,请简述洗涤的方法_____________________________。将洗涤液与母液合并,加入盐酸,过滤后再经过以下步骤可回收大部分浸出液1中的银。试剂a是______________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾K4Fe(CN)6俗名黄血盐,可溶于水,不溶于乙醇。以某电镀厂排放的含NaCN废液为主要原料制备黄血盐的流程如下:

请回答下列问题:
(1)常温下,HCN的电离常数Ka=6.2×10-10。
①实验室配制一定浓度的NaCN溶液时,将NaCN溶解于一定浓度的NaOH溶液中,加水稀释至指定浓度,其操作的目的是_____________。
②浓度均为0.5 mol/L的NaCN和HCN的混合溶液显_________(填“酸”“碱”或“中”)性,通过计算说明:___________________________________。
(2)滤渣1的主要成分是______________(填化学式)。
(3)转化池中发生复分解反应生成K4Fe(CN)6,说明该反应能发生的理由:_____________。
(4)系列操作B为_________________。
(5)实验室中,K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6]可用于治疗Tl2SO4中毒,试写出上述治疗Tl2SO4中毒的离子方程式:_______________。
(6)一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3Fe(CN)6和亚铁氰化钾K4Fe(CN)6的混合溶液。

①K+移向催化剂____________(填“a”或“b”)。
②催化剂a表面发生的反应为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗数的数值,下列说法中正确的是
A.1L1mol/L的K2Cr2O7溶液中
B.1molC60F60分子中碳原子之间共用电子对数为90 NA
C.电解精炼铜时,若阴极得到电子数为2 NA个,则阳极质量减少64g
D.标准状况下,2.24LCl2完全溶于水转移电子数为0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义。有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。

下列说法不正确的是
A. 溶液中H+的移动方向由A极到B极
B. 电池总反应方程式为:2SO2 + O2 + 2H2O = 2H2SO4
C. 正极电极反应式为:SO2+ 2H2O-2e=SO4 2+4H+
D. 当有0.25mol SO2被吸收时,通过H+交换膜的H+的物质的量为0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Na2CO3、NaAlO2的混合溶液中逐滴加入1molL1的盐酸,测得溶液中的CO32、HCO3、AlO2、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。则下列说法正确的是( )(已知:H2CO3的电离平衡常数K1 = 4.3×107,K2 = 5.6×1011;Al(OH)3的酸式电离平衡常数K=6.3×1013)

A. a曲线表示的离子方程式为:AlO2+4H+ = Al3+ + 2H2O
B. M点时生成的CO2为0.05 mol
C. 原混合溶液中的CO32与AlO2的物质的量之比为1:2
D. V1:V2=1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将碘水中的碘萃取出来的实验中,下列说法不正确的是
A. 分液漏斗使用前要检验它是否漏水
B. 萃取剂要求不溶于水,且比水更容易使碘溶解
C. 用CCl4作萃取剂,萃取后液体分层且下层无色
D. 分液时,打开旋塞,使下层液体流出,上层液体从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国医学家证实了3价铬离子(Cr3+)是构成葡萄糖耐量因子的重要组成部分,能够增强胰岛素的作用。构成葡萄糖耐量因子和蛋白质的元素有C、H、O、N、S、Cr等。
(1)Cr的外围电子排布图为_______________________________ 。
(2)SO2分子的空间构型为__________,是__________ 分子(填“极性”或“非极性”);SO32-离子中心原子的杂化方式为__________。
(3)SCN的电子式为_________________,它的等电子体中属于分子的有___________。
(4)四种分子:①CH4、②SO3、③H2O、④NH3,键角由大到小的排列顺序是________(填序号)。
(5)NH3分子可以与H+ 结合生成NH4+,这个过程发生改变的是_____
a. 微粒的空间构型 b. N原子的杂化类型 c. H-N-H的键角 d. 微粒的电子数
(6)由碳元素形成的某种单质的片状和层状结构如图1所示,由碳元素形成的某种晶体的晶胞结构如图2所示,试回答:
①在图1中,碳原子所形成的六元环数、C原子数、C-C键数之比为_____________;
②在图2中,已知阿伏伽德罗常数为NA,晶体密度为ρ g/cm3,则该晶体的棱长为
________________pm(只列式,不计算)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作不正确的是
A. 分液漏斗使用前需要先检查是否漏液
B. 实验中剩余的钠不能再放回原试剂瓶
C. 做焰色反应时,铂丝应用盐酸洗净并灼烧至无色
D. 蒸馏烧瓶加热时需要垫石棉网
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com